HNO3, одноосновная сильная кислота, при обычных условиях бесцветная жидкость; один из наиболее важных продуктов химической промышленности. Структурная формула:
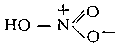
Физические и химические свойства. Плотность безводной А. к. 1522
кг/м3, tпл - 41,15°С,
tкип 84° С. С водой смешивается во всех отношениях, причём образует азеотропную смесь (См.
Азеотропная смесь), содержащую 69,2\% А. к. с
tкип 121,8°C. Известны кристаллогидраты HNO
3․H
2O с
tпл -37,85° С и HNO
3․3H
2O c
tпл -18,5°С. В отсутствии воды А. к. неустойчива, разлагается на свету с выделением кислорода уже при обычных температурах (4HNO
3 = 4NO
2 + 2H
2O + O
2), причём выделяющейся двуокисью азота окрашивается в жёлтый, а при высоких концентрациях NO
2 - в красный цвет. А. к. - сильный окислитель, окисляет серу до серной кислоты, фосфор - до фосфорной кислоты. Только золото, тантал и некоторые платиновые металлы не реагируют с А. к. С большинством металлов А. к. взаимодействует преимущественно с выделением окислов азота: ЗСu + 8HNO
3 = 3Cu(NO
3)
2 + 2NO + 4H
2O. Некоторые металлы, например железо, хром, алюминий, легко растворяющиеся в разбавленной А. к., устойчивы к воздействию концентрированной А. к., что объясняется образованием на поверхности металла защитного слоя окисла. Такая особенность позволяет хранить и перевозить концентрированную А. к. в стальных ёмкостях. Смесь концентрированной А. к. и соляной кислоты (1:3), называется царской водкой, растворяет даже золото и платину. Органические соединения под действием А. к. окисляются или нитруются, причём в последнем случае остаток А. к. - нитрогруппа - NO
2+ замещает в органических соединениях водород (см.
Нитрование). Соли А. к. называютя нитратами (См.
Нитраты), а соли с Na,K, Са, NO
4+ также селитрами (См.
Селитры).
Получение и применение. В 13 в. было описано получение А. к. нагреванием калиевой селитры с квасцами, железным купоросом и глиной. В середине 17 в. И. Р. Глаубер предложил получать А. к. при умеренном (до 150°C) нагревании калиевой селитры с концентрированной серной кислотой: KNO3 + H2SO4 = HNO3 + KHSO4 До начала 20 в. этот способ применяли в промышленности, заменяя калиевую селитру более дешёвой природной чилийской селитрой NaNO3.
Современный способ производства А. к. основан на каталитическом окислении
Аммиака кислородом воздуха. Основные стадии процесса: контактное окисление аммиака до окиси азота: 4NH
3 + 5O
2 = 4NO + 6H
2O; окисление окиси азота до двуокиси и поглощение смеси так называемых "нитрозных газов" водой: 2NO + O
2 = 2NO
2; 3NO
2 + H
2O = 2HNO
3+NO. Смесь аммиака (10 - 12\% ) с воздухом пропускают через нагретую до 750 - 900° С сетку катализатора, которым служат сплавы платины - тройной (93\% Pt, 3\% Rh, 4\% Pd) или двойной (90 - 95\% Pt, 10 - 5\% Rh). Используют также двухступенчатый катализатор (1-я ступень - платиноидная сетка, 2-я - неплатиновый катализатор), что позволяет на 25 - 30\% сократить расход платины. Время контакта воздушно-аммиачной смеси с катализатором не должно превышать 1
мсек, иначе образовавшаяся окись азота разлагается. Вторая стадия процесса - окисление NO до N0
2 и растворение NO
2 в воде - может быть проведена при атмосферном давлении, под давлением до 1
Мн/м2 (10
кгс/см2) или комбинированным способом, при котором под давлением происходит только поглощение нитрозных газов водой. Получают А. к. с концентрациями 45 - 49\% или (при использовании давления) 55 - 58\% . Дистилляцией таких растворов может быть получена А. к. азеотропного состава. Более концентрированную кислоту (до 100\% ) получают перегонкой растворов А.к. с концентрированной H
2SO
4 или прямым синтезом - взаимодействием N
2O
4 с водой (или разбавленной А. к.) и кислородом: 2N
2O
4 + 2H
2O + O
2 = =4HNO
3. В СССР производят 97 - 98\%-ную А. к.
Важнейшие области применения А. к. - производство азотных и комбинированных удобрений, взрывчатых веществ (тринитротолуола и др.), органических красителей. В органическом синтезе широко применяют смесь концентрированной А. к. и серной кислоты - "нитрующую смесь". А. к. используют в камерном способе производства серной кислоты, для получения фосфорной кислоты из фосфора, как окислитель ракетного топлива. В металлургии А. к. применяют для травления и растворения металлов, а также для разделения золота и серебра.
Вдыхание паров А. к. приводит к отравлению, попадание А. к. (особенно концентрированной) на кожу вызывает ожоги. Предельно допустимое содержание А. к. в воздухе промышленных помещений равно 50 мг/м3 в пересчёте на N2O5. Концентрированная А. к. при соприкосновении с органическими веществами
вызывает пожары и взрывы.
Лит.: Атрощенко В. И., Каргин С. И., Технология азотной кислоты, М. - Л., 1949; Миниович М. А., О современном состоянии и о перспективах развития производства разбавленной азотной кислоты, "Журнал прикладной химии", 1958, т. 31, в. 8; Миниович М. А., Азотная кислота, КХЭ, т. 1, М., 1961, с. 74-79.
Э. Б. Шиллер.



![специализированных вагонах-цистернах]] специализированных вагонах-цистернах]]](https://commons.wikimedia.org/wiki/Special:FilePath/Вагон-цистерна для азотной кислоты f002.jpg?width=200)
