Geben Sie ein Wort oder eine Phrase in einer beliebigen Sprache ein 👆
Sprache:
Übersetzung und Analyse von Wörtern durch künstliche Intelligenz ChatGPT
Auf dieser Seite erhalten Sie eine detaillierte Analyse eines Wortes oder einer Phrase mithilfe der besten heute verfügbaren Technologie der künstlichen Intelligenz:
- wie das Wort verwendet wird
- Häufigkeit der Nutzung
- es wird häufiger in mündlicher oder schriftlicher Rede verwendet
- Wortübersetzungsoptionen
- Anwendungsbeispiele (mehrere Phrasen mit Übersetzung)
- Etymologie
Was (wer) ist Азота окислы - definition
Оксид азота; E918; Е918; Окислы азота; Азота оксиды; Кислородные соединения азота
Азота окислы
соединения азота с кислородом. Известны N2O, NO, N2O3, NO2 (и его димер N2O4), N2O5; есть сведения о существовании NO3, не выделенного в свободном состоянии. При высокой температуре в пламени вольтовой дуги, а в природе - при электроразряде из смеси азота с кислородом образуется окись азота NO, которая при охлаждении переходит в NO2. Другие А. о. получают косвенным путём. N2O5 - твёрдое вещество; остальные окислы при обычных условиях газообразны.
Закись азота N2O - бесцветный газ со слабым приятным запахом и сладковатым вкусом; вдыхание смеси воздуха с N2O вызывает состояние, напоминающее опьянение (отсюда название - веселящий газ). Плотность при 0°С и 101 325 н/м2 (760 мм рт. ст.) 1,9804 кг/м3, tкип - 89,5°С, tпл - 102,4°С. 1 объём N2O при 5°C растворяет 1,048 объёма N2O. Химически N2O с водой, растворами кислот и щелочей не реагирует, кислородом не окисляется. Выше 500°C разлагается: 2N2O = 2N2 + O2; поэтому при повышенных температурах действует как сильный окислитель и поддерживает горение. Получают N2O термическим разложением нитрата аммония: NH4NO3=N2O+ 2H2O. В медицине служит для общей анестезии.
Окись азота NO - бесцветный газ, буреющий при соприкосновении с воздухом вследствие окисления до NO2. Плотность при 0°С и 101 325 н/м2 (760 мм рт ст) 1,3402 кг/м3, tкип-151,8°С, tпл-163,6°С. В воде мало растворима (0,0738 объёма в 1 объёме H2O при 0°С). С водой, кислотами и щелочами химически не взаимодействует. Образует многочисленные продукты присоединения, например нитрозилхлорид NOCI. Получают NO действием разбавленной азотной кислоты на некоторые металлы, например: 3Cu + 8HNO3= 3Cu(NO3)2 + 4H2O + 2NO. Окись азота - важный полупродукт окисления аммиака при получении азотной кислоты (См. Азотная кислота).
Азотистый ангидрид (трёхокись азота) N2O3 - в обычных условиях неустойчивое соединение. Разлагается уже при 0°С:
Около 3,5°С кипит с разложением, при 25°C содержит только 10\% недиссоциированного N2O3. При низкой температуре может быть получен в виде тёмно-голубой жидкости, при сильном охлаждении - светло-голубой массы с tпл -102°С. С водой образует азотистую кислоту (См. Азотистая кислота): N2O3 + H2O = 2HNO2, со щелочами - соли (см. Нитриты). N2O3 получают по реакции: N2O4+ 2NO = 2N2O3; практического применения не находит.
Двуокись азота NO2 - бурый газ с удушливым запахом, при 21,15°C - буро-красная жидкость, бледнеющая при дальнейшем охлаждении из-за образования четырёхокиси азота N2O4 , tотв -11,2°С. Взаимодействует с водой с образованием азотной кислоты и окиси азота: 3NO2 + H2O = 2HNO3 + NO; со щелочами образует нитраты и нитриты. Двуокись азота - сильный окислитель; в токе NO2 энергично сгорают уголь, сера, фосфор, органические соединения. В промышленности NO2 получают окислением NO при производстве азотной кислоты, в лаборатории - термическим разложением некоторых нитратов: 2Pb(NO3)2 = 2PbO + O2 + 4NO2. Применяют NO2 как нитрующий агент (см. Нитрование органических соединений).
Азотный ангидрид (пятиокись азота) N2O5 - бесцветные очень летучие кристаллы. Крайне неустойчив и взрывоопасен. Взаимодействует с водой, давая азотную кислоту: N2O5 +Н2O = 2HNO3, со щелочами образует соли - Нитраты. В лаборатории получают по реакции: 2HNO3 + P2O5 = N2O5+ 2HPO3. Практического применения не находит. Все А. о. физиологически активны.
Лит. см. при ст. Азот, Азотная кислота.
Фториды азота
СТРАНИЦА ЗНАЧЕНИЙ В ПРОЕКТЕ ВИКИМЕДИА
Азота фториды
неорганические соединения, содержащие связь N-F, например трифторид азота NF3, тетрафторгидразин N2F4, дифторамин NF2H, фтористый нитрозил FNO и др. Ф. а. - бесцветные газы со специфическим запахом. При нагревании разлагаются на элементы или трифторид азота и азот (за исключением NF3 и FNO). Проявляют свойства сильных окислителей. С органическими соединениями некоторые Ф. а. образуют многочисленные органические вещества, содержащие группы -NF2 и -NONF. Особенность Ф. а. состоит в том, что при взаимодействии с сильными льюисовскими кислотами (см. Кислоты и основания) они образуют соли с фторазотными катионами 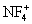 ,
, 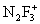 ,
, 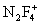 , F2NO+.
, F2NO+.
Трифторид азота, NF3 - газ; tпл - 208,5°С, tkип - 129,1°С. Окислительная способность проявляется при высоких температурах. Превращается в тетрафторгидразин при повышенных температурах и в присутствии меди, железа, ртути или угля. Получается электролизом расплава дифторида аммония или фторированием азотсодержащих веществ. Применяется в производстве тетрафторгидразина.
Тетрафторгидразин, N2F4 - газ; tпл - 161,5°С, tkип - 74,2°С. Способен к диссоциации: N2F4 ⇔ 2NF2. При 150°С и давлении 0,1 Мн/м2 (1 кгс/см2) степень диссоциации 0,2. Диссоциация N2F4 обусловливает его дифтораминирующее действие, которое проявляется, например, в присоединении к олефинам:
. Тетрафторгидразин получается конверсией трифторида азота над углём (промышленный метод), разложением NF2H или окислением его растворов. Применяется для синтеза органических дифтораминосоединений.
Дифторамин, NF2H - газ; tпл - 116°С, tkип - 23°С. Взрывается при ударе (особенно в жидком и твёрдом состояниях). Проявляет амфотерные свойства. В реакциях действует как дифтораминирующий агент. Получается действием серной кислоты на дифтораминомочевину (продукт фторирования мочевины) или на трифенилметил дифторамин, синтезируемый из N2F4 и трифенилметилхлорида в присутствии ртути. Применяется для синтеза органических дифтораминосоединений.
Лит.: Панкратов А. В., Химия фторидов азота, М., 1973.
А. В. Панкратов.
Фториды азота
СТРАНИЦА ЗНАЧЕНИЙ В ПРОЕКТЕ ВИКИМЕДИА
Азота фториды
Фториды азота — неорганические соединения азота со фтором. Известны трифторид азота NF, Дифтордиазин NF, тетрафторгидразин NF, азид фтора FN, а также оксифторид азота NOF.
Wikipedia
Оксиды азота
Окси́ды азо́та — неорганические бинарные соединения азота с кислородом.
Beispiele aus Textkorpus für Азота окислы
1. Здесь прекрасно понимают: никакие фильтры, о которых твердят на заводе, не в состоянии удержать оксиды азота и углерода, диоксиды азота, окислы кремния и прочих "летучих голландцев", сопровождающих производство керамического кирпича.
