количество теплоты, поглощаемой телом при нагревании на 1 градус; точнее - отношение количества теплоты, поглощаемой телом при бесконечно малом изменении его температуры, к этому изменению Т. единицы массы вещества (г, кг) называется удельной теплоёмкостью, 1 моля вещества - мольной (молярной) Т.
Количество теплоты, поглощённой телом при изменении его состояния, зависит не только от начального и конечного состояний (в частности, от их температуры), но и от способа, которым был осуществлен процесс перехода между ними. Соответственно от способа нагревания тела зависит и его Т. Обычно различают Т. при постоянном объёме (
Cv) и Т. при постоянном давлении (
Ср), если в процессе нагревания поддерживаются постоянными соответственно его объём или давление. При нагревании при постоянном давлении часть теплоты идёт на производство работы расширения тела, а часть - на увеличение его внутренней энергии (См.
Внутренняя энергия)
, тогда как при нагревании при постоянном объёме вся теплота расходуется только на увеличение внутренней энергии; в связи с этим
cp всегда больше, чем
cv. Для газов (разреженных настолько, что их можно считать идеальными) разность мольных Т. равна
cp -
cv =
R, где
R - универсальная
Газовая постоянная, равная 8,314
дж/(
моль․ К)
, или 1,986
кал/(
моль․ град)
. У жидкостей и твёрдых тел разница между
Ср и
Cv сравнительно мала.
Теоретическое вычисление Т., в частности её зависимости от температуры тела, не может быть осуществлено с помощью чисто термодинамических методов и требует применения методов статистической физики (См.
Статистическая физика)
. Для газов вычисление Т. сводится к вычислению средней энергии теплового движения отдельных молекул. Это движение складывается из поступательного и вращательного движений молекулы как целого и из колебаний атомов внутри молекулы. Согласно классической статистике (то есть статистической физике, основанной на классической механике), на каждую степень свободы поступательного и вращательного движений приходится в мольной Т. (
Cv) газа величина, равная.
R /2; а на каждую колебательную степень свободы -
R, это правило называется
Равнораспределения законом
. Частица одноатомного газа обладает всего тремя поступательными степенями свободы, соответственно чему его Т. должна составлять
3/
2 R [то есть около 12,5
дж/Кмоль․ К), или 3
кал/(
моль․град)]
, что хорошо согласуется с îïûòîì. Ìîëåêóëà äâóõàòîìíîãî ãàçà îáëàäàåò òðåìÿ ïîñòóïàòåëüíûìè, äâóìÿ âðàùàòåëüíûìè è îäíîé êîëåáàòåëüíîé ñòåïåíÿìè ñâîáîäû, è çàêîí ðàâíîðàñïðåäåëåíèÿ ïðèâîäèò ê çíà÷åíèþ
Cv = 1/2R; между тем опыт показывает, что Т. двухатомного газа (при обычных температурах) составляет всего
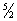 R.
R. Это расхождение теории с экспериментом связано с тем, что при вычислении Т. необходимо учитывать квантовые эффекты, то есть пользоваться статистикой, основанной на квантовой механике (См.
Квантовая механика)
. Согласно квантовой механике, всякая система частиц, совершающих колебания или вращения (в том числе молекула газа), может обладать лишь определёнными дискретными значениями энергии. Если энергия теплового движения в системе недостаточна для возбуждения колебаний определённой частоты, то эти колебания не вносят своего вклада в Т. системы (соответствующая степень свободы оказывается "замороженной" - к ней неприменим закон равнораспределения). Температура
Т, при достижении которой закон равнораспределения оказывается применимым к вращательной или колебательной степени свободы, определяется квантово-механическим соотношением
T >> hv/k (
v - частота колебаний,
h -
Планка постоянная, k -
Больцмана постоянная)
. Интервалы между вращательными уровнями энергии двухатомной молекулы (деленные на
k) составляют всего несколько градусов и лишь для такой лёгкой молекулы, как молекула водорода, достигают сотни градусов. Поэтому при обычных температурах вращательная часть Т. двухатомных (а также многоатомных) газов подчиняется закону равнораспределения. Интервалы же между колебательными уровнями энергии достигают нескольких тысяч градусов и поэтому при обычных температурах закон равнораспределения совершенно неприменим к колебательной части Т. Вычисление Т. по квантовой статистике приводит к тому, что колебательная Т. быстро убывает при понижении температуры, стремясь к нулю. Этим объясняется то обстоятельство, что уже при обычных темïåðàòóðàõ êîëåáàòåëüíàÿ ÷àñòü Ò. ïðàêòè÷åñêè îòñóòñòâóåò è Ò. äâóõàòîìíîãî ãàçà ðàâíà
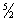 R
R âìåñòî
1/2 R. При достаточно низких температурах Т. вообще должна вычисляться с помощью квантовой статистики. Как оказывается, Т. убывает с понижением температуры, стремясь к нулю при
Т → 0 в согласии с так называемом принципом Нернста (третьим началом термодинамики (См.
Третье начало термодинамики))
. В твёрдых (кристаллических) телах тепловое движение атомов представляет собой малые колебания вблизи определённых положений равновесия (узлов кристаллической решётки). Каждый атом обладает, таким образом, тремя колебательными степенями свободы и, согласно закону равнораспределения, мольная Т. твёрдого тела (Т. кристаллической решётки) должна быть равной 3
nR, где
n - число атомов в молекуле. В действительности, однако, это значение - лишь предел, к которому стремятся Т. твёрдого тела при высоких температурах. Он достигается уже при обычных температурах у многих элементов, в том числе металлов (См.
Металлы) (
n = 1, так называемый
Дюлонга и Пти закон) и у некоторых простых соединений [NaCI, MnS (
n = 2), PbCl
2 (
n = 3) и др.]; у сложных соединений этот предел фактически никогда не достигается, т. к. ещё раньше наступает плавление вещества или его разложение.
Квантовая теория Т. твёрдых тел была развита А.
Эйнштейном (1907) и П. Дебаем (См.
Дебай) (1912). Она основана на квантовании колебательного движения атомов в кристалле. При низких температурах Т. твёрдого тела оказывается пропорциональной кубу абсолютной температуры (так называемый закон Дебая). Критерием, позволяющим различать высокие и низкие температуры, является сравнение с характерным для каждого данного вещества параметром - так называемой характеристической, или дебаевской, температурой Θ
D. Эта величина определяется спектром колебаний атомов в теле и, тем самым, существенно зависит от его кристаллической структуры. Обычно Θ
D - величина порядка нескольких сот К, но может достигать (например, у алмаза) и тысяч К (см.
Дебая температура)
. У металлов определённый вклад в Т. дают также и электроны проводимости. Эта часть Т. может быть вычислена с помощью квантовой статистики Ферми, которой подчиняются электроны. Электронная Т. металла пропорциональна первой степени абсолютной температуры. Она представляет собой, однако, сравнительно малую величину, её вклад в Т. становится существенным лишь при температурах, близких к абсолютному нулю (порядка нескольких градусов), когда обычная Т., связанная с колебаниями атомов кристаллической решётки, представляет собой ещё меньшую величину.
Ниже приводятся значения Т. [ккал/(кг․ град)] некоторых газов, жидкостей и твёрдых тел при температуре 0 °С и атмосферном давлении (1 ккал = 4,19кдж).
Àçîò...................6,8 Ñâèíåö................0,030
Âîäîðîä ............6,84 Êâàðö .................0,174
Æåëåçî..............0,104 Ñïèðò ýòèëîâûé...0,547
Ìåäü..................0,091 Àëþìèíèé ..........0,210
Âîäà..................1,008
Лит.: Кикоин И. К., Кикоин А. К,, Молекулярная физика, М., 1963; Ландау Л. Д., Лифшиц Е. М., Статистическая физика, 2 изд., М., 1964 (Теоретическая физика, т. 5).
Е. М. Лифшиц.



