I
Га́зы (французское gaz; название предложено голланским учёным Я. Б. Гельмонтом
агрегатное состояние вещества, в котором его частицы не связаны или весьма слабо связаны силами взаимодействия и движутся свободно, заполняя весь предоставленный им объём. Вещество в газообразном состоянии широко распространено в природе. Г. образуют атмосферу Земли, в значительных количествах содержатся в твёрдых земных породах, растворены в воде океанов, морей и рек. Солнце, звёзды, облака межзвёздного вещества состоят из Г. - нейтральных или ионизованных (плазмы). Встречающиеся в природных условиях Г. представляют собой, как правило, смеси химически индивидуальных Г.
Г. обладают рядом характерных свойств. Они полностью заполняют сосуд, в котором находятся, и принимают его форму. В отличие от твёрдых тел и жидкостей, объём Г. существенно зависит от давления и температуры. Коэффициент объёмного расширения Г. в обычных условиях (0-100°С) на два порядка выше, чем у жидкостей, и составляет в среднем 0,003663 град-1. В табл. приведены данные о физических свойствах наиболее распространённых Г.
Любое вещество можно перевести в газообразное состояние надлежащим подбором давления и температуры. Поэтому возможную область существования газообразного состояния графически удобно изобразить в переменных: давление
р - температура Т (в
р, Т-диаграмме,
рис. 1). При температурах ниже критической
Тк (см.
Критическое состояние) эта область ограничена кривыми сублимации (См.
Сублимация) (возгонки) / и парообразования (См.
Парообразование)
II. Это означает, что при любом давлении ниже критического
рк существует температура
Т (см. рис. 1), определяемая кривой сублимации или парообразования, выше которой вещество становится газообразным. В состояниях на кривой
1 (ниже тройной точки (См.
Тройная точка)
Tp)
газ находится в равновесии с твёрдым веществом (твёрдой фазой), а на кривой
II (между тройной и критической точкой
К.)
- с жидкой фазой. Газ в этих состояниях обычно называют
Паром вещества.
При температурах ниже
Тк можно сконденсировать Г. - перевести его в др. агрегатное состояние (твёрдое или жидкое). При этом фазовое превращение Г. в жидкость или твёрдое тело происходит скачкообразно: весьма малое изменение давления приводит к конечному изменению ряда свойств вещества (например, плотности (См.
Плотность)
, энтальпии (См.
Энтальпия)
, теплоёмкости (См.
Теплоёмкость) и др.). Процессы конденсации Г., особенно
Сжижение газов, имеют важное техническое значение.
При
Т >
Тк граница газообразной области условна, поскольку при этих температурах фазовые превращения не происходят. В ряде случаев за условную границу между Г. и жидкостью при сверхкритических температурах и давлениях принимают критическую изохору (См.
Изохора) вещества (кривую постоянной плотности или удельного объёма, см. рис. 1), в непосредственной близости от которой свойства вещества изменяются, хотя и не скачком, но особенно быстро.
В связи с тем что область газового состояния очень обширна, свойства Г. при изменении температуры и давления могут меняться в широких пределах. Так, в нормальных условиях (при 0° С и атмосферном давлении) плотность Г. примерно в 1000 раз меньше плотности того же вещества в твёрдом или жидком состоянии. При комнатной температуре, но давлении, в 10
17 раз меньшем атмосферного (предел, достигнутый современной вакуумной техникой (См.
Вакуумная техника))
, плотность Г. составляет около 10
-20 г/см3. В космических условиях плотность Г. может быть ещё на 10 порядков меньше (Газы10
-30/
см3).
С другой стороны, при высоких давлениях вещество, которое при сверхкритических температурах можно считать Г., обладает огромной плотностью (например, в центре некоторых звёзд Газы109 г/см3). В зависимости от условий в широких пределах изменяются и др. свойства Г. - теплопроводность, вязкость и т. д.
Молекулярно-кинетическая теория Г. Молекулярно-кинетическая теория рассматривает Г. как совокупность слабо взаимодействующих частиц (молекул или атомов), находящихся в непрерывном хаотическом (тепловом) движении. На основе этих простых представлений кинетической теории удаётся объяснить основные физические свойства Г., особенно полно - свойства разреженных Г.
У достаточно разреженных Г. средние расстояния между молекулами оказываются значительно больше радиуса действия межмолекулярных сил. Так, например, при нормальных условиях в 1
см3 Г. находитсяГазы 10
19 молекул и среднее расстояние между ними составляет Газы 10
-6 см, или Газы 100 Å, тогда как межмолекулярное взаимодействие не существенно на расстояниях свыше 5-10 Å. Следовательно, в таких условиях молекулы взаимодействуют лишь при сближении на расстояние действия межмолекулярных сил. Такое сближение принято трактовать как столкновение молекул. Радиус действия межмолекулярных сил в рассмотренном примере в 10-20 раз меньше среднего расстояния между молекулами, так что общий объём, в котором эти силы могут сказываться (как бы "собственный объём" всех молекул), составляет 10
-3-10
-4 от полного объёма Г. Это позволяет считать собственный объём молекул Г. в нормальных условиях пренебрежимо малым и рассматривать молекулы как материальные точки. Газ, молекулы которого рассматриваются как не взаимодействующие друг с другом материальные точки, называется идеальным. При тепловом равновесии идеального Г. все направления движения его молекул равновероятны, а скорости распределены в соответствии с
Максвелла распределением
. На
рис. 2 приведён график этого распределения для азота при температурах 20 и 500°С. Из графика видно, что подавляющее большинство молекул имеет близкие значения скорости (максимум кривой соответствует скорости наиболее вероятной при данной температуре), но существует также известная часть молекул с малыми и очень большими скоростями. При помощи максвелловского распределения может быть определена т. н. средняя квадратичная скорость молекул

связанная с температурой
Т газа соотношением

Здесь
k - Больцмана постоянная, m - масса молекулы. Уравнение (1) позволяет установить связь между средней кинетической энергией одной молекулы и температурой газа:
Эту зависимость часто рассматривают как молекулярно-кинетическое толкование температуры - температура есть мера кинетической энергии молекул.
Поскольку молекулы идеального Г. обладают лишь кинетической энергией,
Внутренняя энергия такого Г. не зависит от занимаемого им объёма (закон Джоуля).
Молекулярно-кинетическая теория рассматривает давление Г. на стенки сосуда, в котором он находится, как воздействие ударов молекул, усреднённое по поверхности и времени. Количественно давление р определяется импульсом, передаваемым молекулами в единицу времени единице площади стенки:
где
n - число молекул в единице объёма. Уравнения (2) и (3) позволяют записать
Уравнение состояния идеального Г. в виде
p = nkT. (4)
pv = RT. (5)
Здесь
R =
kN - универсальная
Газовая постоянная, v - объём, приходящийся на 1
моль. уравнение Клапейрона обобщает эмпирические газовые законы Бойля - Мариотта и Гей-Люссака (см.
Бойля - Мариотта закон,
Гей-Люссака законы)
. Из уравнения (5) следует также, что при одинаковых температуре и давлении идеальные Г., взятые в количестве 1
моля, имеют равные объёмы и в любом таком Г. в единице объёма содержится равное количество молекул (см.
Авогадро закон)
. В условиях теплового равновесия температура и давление Г. по всему его объёму одинаковы, молекулы движутся хаотично, в Г. нет упорядоченных потоков. Возникновение в Г. перепадов (градиентов) температуры или давления приводит к нарушению равновесия и переносу в направлении градиента энергии, массы или др. физических величин.
Кинетические свойства Г. - теплопроводность, диффузию, вязкость - молекулярно-кинетическая теория рассматривает с единой точки зрения: диффузию (См.
Диффузия) как перенос молекулами массы,
Теплопроводность как перенос ими энергии,
Вязкость как перенос количества движения. Модель идеального Г. для анализа явлений переноса непригодна, ибо в этих процессах существенную роль играют столкновения молекул (при которых происходит передача какой-нибудь из переносимых величин, например энергии) и "размер" молекул (влияющий на частоту столкновений). Поэтому в простейшем случае явления переноса в Г. рассматриваются для разреженного Г., молекулы которого в первом приближении считаются упругими шариками с определённым диаметром σ
, причём эти шарики взаимодействуют друг с другом только в момент соударения. В этом приближении диаметр молекулы связан простым соотношением с её средней длиной свободного пробега (См.
Длина свободного пробега)
l̅:
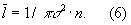
Размер
l̅ существенно влияет на процессы переноса в разреженном Г. В частности, если характерный размер объёма, занимаемого Г., больше
l̅, то теплопроводность и вязкость Г. не зависят от давления. Наоборот, когда
l̅ больше характерного размера, теплопроводность и вязкость Г. с уменьшением давления (а значит, и числа столкновений) начинают падать. На этом явлении, в частности, основаны теплоизолирующие свойства сосудов с двойными стенками, воздух между которыми откачан (см.
Дьюара сосуды).
В более строгой молекулярной теории при анализе явлений переноса в разреженных газах учитывается взаимодействие молекул при любых расстояниях между ними. Характер взаимодействия определяется т. н. потенциалом взаимодействия (см.
Межмолекулярное взаимодействие)
. Строгое рассмотрение динамики парных взаимодействий (столкновений) приводит к тому, что в формулах для расчёта коэффициентов переноса появляются т. н. интегралы столкновений, являющиеся функциями только приведённой температуры
T* = kT/ε. Эта температура характеризует отношение кинетической энергии молекул (
ГазыkT) к их потенциальной энергии (
ε - глубина потенциальной ямы (См.
Потенциальная яма) при данном потенциале взаимодействия). Интегралы столкновений учитывают то обстоятельство, что сталкивающиеся молекулы в зависимости от их кинетической энергии, а значит и температуры Г., могут сближаться на различные расстояния, т. е. как бы изменять свой эффективный размер.
Свойства реальных Г. При повышении плотности изменяются свойства Г., они перестают быть идеальными. Уравнение состояния (5) оказывается неприменимым, т. к. средние расстояния между молекулами Г. становятся сравнимыми с радиусом межмолекулярного взаимодействия. Для описания термодинамических свойств неидеальных, или, как их чаще называют, реальных, Г. пользуются различными уравнениями состояния, имеющими более или менее строгое теоретическое обоснование. Простейшим примером уравнения, которое качественно правильно описывает основные отличия реального Г. от идеального, служит уравнение Ван-дер-Ваальса. Оно учитывает, с одной стороны, существование сил притяжения между молекулами (их действие приводит к уменьшению давления Г.), с другой стороны - сил отталкивания, препятствующих безграничному сжатию Г. (см.
Ван-дер-Ваальса уравнение).
Значения вириальных коэффициентов В, С и т. д. определяются соударениями молекул: парными (В), тройными (С) и более высокого порядка для последующих коэффициентов. Существенно, что вириальные коэффициенты являются функциями только температуры.
В Г. малой плотности наиболее вероятны парные столкновения молекул, т. е. для такого Г. в разложении (7) можно пренебречь всеми членами после члена с коэффициента
В. В соответствии с температурным изменением
В, при т. н. температуре Бойля
ТВ (см.
Бойля точка)
В обращается в нуль, и умеренно плотный Г. ведёт себя как идеальный, т. е. подчиняется уравнению (5). Физически это означает, что при
ТВ межмолекулярные силы притяжения и отталкивания практически компенсируют друг друга. Существование межмолекулярного взаимодействия в той или иной степени сказывается на всех свойствах реальных Г. Внутренняя энергия реального Г. оказывается зависящей от его объёма (от расстояний между молекулами), т. к. потенциальная энергия молекул определяется их взаимными расстояниями.
С межмолекулярным взаимодействие связано также изменение температуры реального Г. при протекании его с мало постоянной скоростью через пористую перегородку (этот процесс называется
Дросселированием). Мерой изменения температуры Г при дросселировании служит Джоуля - Томсона коэффициент который в зависимости от условий может быть положительным (охлаждение Г.), отрицательным (нагрев Г.) либо равным нулю при т. н. температуре инверсии (см. Джоуля - Томсона явление (См.
Джоуля - Томсона эффект)). Эффект охлаждения Г при дросселировании широко применяется в технике как один из методов сжижения газов.
Внутреннее строение молекул Г. слабо влияет на их термические свойства (давление, температуру, плотность и связь между ними). Для этих свойств в первом приближении существенна только молекулярная масса Г. Напротив, калорические свойства Г. (теплоёмкость, энтропия и др.), а также его электрические и магнитные свойства существенно зависят от внутреннего строения молекул. Например, для расчёта (в первом приближении) теплоёмкости Г. при постоянном объёме
cv необходимо знать число внутренних степеней свободы молекулы (т. е. число возможных внутренних движений)
iвн. В соответствии с
Равнораспределения законом
классической статистической физики на каждую степень свободы молекулы Г. (поступательную, колебательную, вращательную) приходится энергия, равная
1/
2 ·
kT. Отсюда теплоёмкость 1
моля 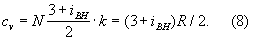
Для точного расчёта калорических свойств Г. необходимо знать уровни энергии молекулы, сведения о которых в большинстве случаев получают из анализа спектров Г. Для большого числа веществ в состоянии идеального Г. калорические свойства вычислены с высокой точностью и их значения представлены в виде таблиц до температур 10-22 тыс. градусов.
Электрические свойства Г. связаны в первую очередь с возможностью ионизации (См.
Ионизация) молекул или атомов, т. е. с появлением в Г. электрически заряженных частиц (ионов и электронов). При отсутствии заряженных частиц Г. являются хорошими диэлектриками. С ростом концентрации зарядов электропроводность Г. увеличивается. Зависимость электропроводности Г. от различных физических факторов рассмотрена в ст.
Электрический разряд в газах.
При температурах начиная с нескольких тыс. градусов всякий Г. частично ионизуется и превращается в плазму (См.
Плазма). Если концентрация зарядов в плазме невелика, то свойства её мало отличаются от свойств обычного Г.
По магнитным свойствам Г. делятся на диамагнитные (к ним относятся, например, инертные газы, H
2, N
2, CO
2, H
2O) и парамагнитные (например, O
2). Диамагнитны те Г., молекулы которых не имеют постоянного магнитного момента и приобретают его лишь под влиянием внешнего поля (см.
Диамагнетизм). Те же Г., у которых молекулы обладают постоянным магнитным моментом, во внешнем магнитном поле ведут себя как парамагнетики (см.
Парамагнетизм). Учёт межмолекулярного взаимодействия и внутреннего строения молекул необходим при решении многих проблем физики Г., например при исследовании влияния верхних разреженных слоев атмосферы на движение ракет и спутников (см.
Газовая динамика,
Аэродинамика разреженных газов).
В современной физике Г. называют не только одно из агрегатных состояний вещества. К Г. с особыми свойствами относят, например, совокупность свободных
Электронов в металле (электронный Г.),
Фононов в жидком гелии (фононный Г.) и т. д. Г. элементарных частиц (См.
Элементарные частицы) и квазичастиц (См.
Квазичастицы) обладающих целым
Спином, т. н.
бозонов (например, фотонов, π-мезонов, фононов), называется бозе-газом. Его свойства рассматривает квантовая статистика Бозе - Эйнштейна. Свойства частиц Г. с полуцелым спином -
Фермионов (например, электронов, нейтронов, нейтрино, дырок проводимости и др.) рассматривает квантовая статистика Ферми - Дирака (см.
Статистическая физика).
Физические свойства газов
----------------------------------------------------------------------------------------------------------------------------------------------------------------------------
| Свойства газов | Азот N2 | Аргон Ar | Водород H | Воздух | Кислород O2 | Углекислый газ |
| | | | 2 | | | CO2 |
|--------------------------------------------------------------------------------------------------------------------------------------------------------------------------|
| Масса 1 моля (г) | 28,02 | 39,94 | 2,016 | 28,96 | 32,00 | 44,00 |
|--------------------------------------------------------------------------------------------------------------------------------------------------------------------------|
| Плотность при 0°C и 1 ат* ( | 1,2506 | 1,7839 | 0,0899 | 1,2928 | 1,4290 | 1,976 |
| кг/м3) | | | | | | |
|--------------------------------------------------------------------------------------------------------------------------------------------------------------------------|
| Теплоемкость при | 20,85 | 12,48 | 20,35 | 20,81 | 20,89 | 30,62 (55°C) |
| постоянном объеме сv и | | | | | | |
| 0°C (кдж/моль•град) | | | | | | |
|--------------------------------------------------------------------------------------------------------------------------------------------------------------------------|
| Скорость звука при 0°C ( | 333,6 | 319 | 1286 | 331,5 | 314,8 | 260,3 |
| м/сек) | | | | | | |
|--------------------------------------------------------------------------------------------------------------------------------------------------------------------------|
| Вязкость η при 0°C (η•106 | 16,6 | 21,2 | 8,4 | 17,1 | 19,2 | 13,8 |
| н•сек /м2) | | | | | | |
|--------------------------------------------------------------------------------------------------------------------------------------------------------------------------|
| Теплопроводность λ при | 2,43 | 1,62 | 16,84 | 2,41 | 2,44 | 1,45 |
| 0°C (λ•102 дж/м•сек•град) | | | | | | |
|--------------------------------------------------------------------------------------------------------------------------------------------------------------------------|
| Диэлектрическая | 1,000588 | 1,000536 | 1,000272 | 1,000590 | 1,000531 | 1,000988 |
| проницаемость ε при 0°C и | | | | | | |
| 1 ат* | | | | | | |
|--------------------------------------------------------------------------------------------------------------------------------------------------------------------------|
| Удельная магнитная | -0,43 | -0,49 | -1,99 | - | +107,8 | 0,48 |
| восприимчивость χ при | | | | | | |
| 20°C (χ•106 на 1 г) | | | | | | |
----------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Лит.: Кириллин В. А., Сычев В. В. и Шейндлин А. Е., Техническая термодинамика, М., 1969; Кикоин И. К. и Кикоин А. К., Молекулярная физика, М., 1963; Гиршфельдер Дж., Кертисс Ч., Берд Р., Молекулярная теория газов и жидкостей, пер. с англ., М., 1961; Термодинамические свойства индивидуальных веществ. Справочник, под ред. В. П. Глушко, 2 изд., т. 1-2, М., 1962.
Э. Э. Шпильрейн.
Рис. 1. р, Т-диаграмма состояния вещества. Область газообразного состояния заштрихована. Со стороны низких температур и давлений она ограничена кривыми сублимации (I) и парообразования (II). Тр - тройная точка, К - критическая точка. Штриховой линией показана критическая изохора вещества.
Рис. 2. Распределение Максвела для молекул азота при температурах 20 и 500°С. По оси ординат отложена доля молекул (в \%), обладающих скоростями между с и (с + 10)
м/сек; с
н - наиболее вероятная скорость, которой обладает наибольшее число молекул при данной температуре;
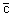
- средняя арифметическая скорость молекул;
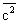
- средняя квадратичная скорость.
в технике, применяются главным образом в качестве топлива; сырья для химической промышленности: химических агентов при сварке, газовой химико-термической обработке металлов, создании инертной или специальной атмосферы, в некоторых биохимических процессах и др.; теплоносителей; рабочего тела для выполнения механической работы (огнестрельное оружие, реактивные двигатели и снаряды, газовые турбины, парогазовые установки, пневмотранспорт и др.): физической среды для газового разряда (в газоразрядных трубках и др. приборах). В технике используется свыше 30 различных Г.
Как топливо применяют природные
Газы горючие и получаемые искусственно в виде основной (генераторный Г.) или побочной (коксовый, доменный и др. Г.) продукции. Основные потребители природного Г. в чёрной металлургии - доменное и мартеновское производство. С использованием природного Г. производится ежегодно около 60\% цемента, 60\% стекла, свыше 60\% керамзита, свыше 60\% керамики. Перевод стекловаренных печей на природный Г. значительно улучшает технико-экономические показатели производства стекла. В топливном балансе машиностроительной промышленности на долю горючего Г. приходится около 40\%. Основными потребителями являются нагревательные и термические печи. Применение в этих печах природного Г. вместо др. видов топлива позволяет снизить стоимость нагрева, улучшить его качество, повысить кпд печей и создать более благоприятные санитарно-гигиенические условия в производственных помещениях. В топливном балансе электростанций СССР удельный вес природного Г. составляет около 20\%. Применение природного Г. на электростанциях даёт значительный эффект. Кпд котельных установок на электростанциях при переводе с твёрдого на газовое топливо увеличивается на 1-4\%; уменьшается на 21-26\% количество обслуживающего персонала. Суммарное снижение расхода топлива за счёт повышения кпд и снижения расхода электроэнергии на собственные нужды составляет 6-7\%. Сжигание Г. в топках котлов малой производительности увеличивает кпд по сравнению с котлами, использующими твёрдое топливо, на 7-20\% (в зависимости от сорта топлива) и позволяет повысить производительность на 30\% и более. Использование природного Г. открывает широкие возможности для создания простых, менее металлоёмких и более экономичных котлов (паровых и водогрейных), работающих на природном Г.
Некоторые Г. являются в то же время исходным сырьём для технологических процессов в химической промышленности (из них вырабатывается около 200 видов различных химических продуктов); на природном Г. работает ряд крупнейших химических комбинатов СССР.
Из числа Г., используемых в качестве химических агентов, воздух (атмосферный или обогащенный кислородом) и кислород получили наибольшее распространение в металлургических, химических и смежных с ними отраслях промышленности (см.
Воздух и
Кислород в технике). Большое значение имеют также многие др. Г.: ацетилен, хлор, фтор и редкие Г.
При газовой сварке большей частью используется пламя ацетилено-кислородной смеси, позволяющее развивать очень высокую температуру (около 3200 °С). В отдельных случаях применяют атомноводородную сварку, основанную на нагреве металла водородом, превращенным в атомарное состояние под действием электрической дуги.
Тепловую обработку металлов в печах часто сопровождают воздействием химических агентов, находящихся в газообразном состоянии. Насыщение поверхностного слоя стали углеродом (см.
Цементация) производится путём длительного нагрева её в атмосфере Г., диссоциирующих с выделением атомарного углерода. В установках промышленного типа для газовой цементации применяют: природный Г., бутан-пропановую смесь и др. Во избежание чрезмерного выделения сажи (или смолистых веществ) к этим Г. подмешивают генераторный газ или дымовые газы, очищенные от углекислого газа и паров воды.
Г. как химические агенты применяются также в практике химико-термической обработки поверхности стали при её азотировании (См.
Азотирование), цианировании (См.
Цианирование), алитировании (См.
Алитирование), хромировании (См.
Хромирование) и др. При газовой цементации стали алюминием (или хромом) её нагревают в парах хлористого алюминия (хрома). Азот, генераторный газ из антрацита или древесного угля, продукты горения некоторых Г. (после удаления из них углекислого газа и паров воды) и продукты диссоциации аммиака в металлообрабатывающей промышленности служат в качестве специальных атмосфер для борьбы с окислением и обезуглероживанием металлов, которые происходят при их нагреве в атмосфере воздуха или дымовых газов.
В качестве инертных веществ для продувки взрывоопасной аппаратуры (газгольдеров, газоочистных коробок, коммуникаций и т. п.) применяют водяной пар, углекислый газ и азот, а также смесь углекислого газа с азотом, например продукты горения газообразного топлива, сжигаемого с малым избытком воздуха. Технологические аппараты большой ёмкости продуваются инертными газами перед их заполнением Г. (например, водородом). При этом вытесняется находящийся в аппарате атмосферный воздух и предотвращается образование взрывчатой смеси Г. - воздух.
В электроламповой промышленности для наполнения ламп накаливания применяются азот, криптон, ксенон и др. Наполнение ламп накаливания инертным газом уменьшает скорость испарения нити и т. о. увеличивает срок службы ламп. Использование для этих целей некоторых редких Г. позволяет значительно (до 30\%) увеличить световую отдачу ламп накаливания, что имеет большое значение, т. к. на нужды освещения расходуется около 20\% всей вырабатываемой в СССР энергии. Широко распространено наполнение ламп накаливания аргоно-азотной смесью, особенно подходящими наполнителями являются криптон и ксенон, обладающие высокой плотностью и минимальной теплопроводностью.
Г. применяются также для интенсификации некоторых биохимических процессов, Углекислый газ и чистые продукты горения бессернистого топлива могут быть и пользованы в качестве углекислого удобрения. Повышенное содержание углекислого газа (до 0,3\%) в атмосфере теплиц и оранжерей ускоряет рост и увеличивает плодоношение некоторых растений. Дозревание сорванных овощей и плодов (томатов, яблок и др.) можно ускорить хранением их в атмосфере этилена.
В качестве теплоносителей широко распространены следующие Г.: продукты горения (дымовые Г.), воздух и реже газообразные продукты экзотермических процессов (окисления аммиака, получения серного ангидрида и др.). Дымовые газы как теплоноситель используют: для непосредственного обогрева изделий или материалов в печах и сушилках; для получения и подогрева промежуточных теплоносителей (водяного пара, горячей воды, воздуха и др.). Для регулирования процесса нагрева дымовыми газами их можно разбавлять воздухом или отходящими газами. Иногда дымовые газы служат для транспортировки угольной пыли и её подсушки во взвешенном состоянии, В этих случаях дымовые газы являются не только теплоносителем, но и физической средой для переноса твёрдых тел, находящихся в пылевидном состоянии. Воздух как промежуточный теплоноситель используют в тех случаях, когда недопустимо загрязнение нагреваемого продукта сажей и золой, содержащимися в некоторых дымовых газах. Чаще всего воздух как теплоноситель применяется в сушилках и в некоторых системах отопления помещений.
В качестве рабочих веществ для совершения механической работы Г. распространены в газовых турбинах (См.
Газовая турбина), в огнестрельном оружии, в реактивных двигателях (См.
Реактивный двигатель) и снарядах, а также в двигателях внутреннего сгорания. Для наполнения дирижаблей и аэростатов используются Г., имеющие невысокую плотность.
Электрический разряд в Г. (или парах) широко применяется в электротехнике для выпрямления переменного тока, преобразования постоянного тока в переменный, генерации электрических колебаний, освещения газосветными лампами и ми. др. Подбором соответствующих газов или паров металлов можно повышать излучение газосветных ламп на заданном участке спектра. Этим достигается увеличение общей световой отдачи источника света (см.
Электрический разряд в газах,
Газосветная трубка).
Лит.: Кортунов А. К., Газовая умышленность СССР, М., 1967; Спейшер В. А., Сжигание газа на электростанциях и в промышленности, 2 изд., М., 1967; Использование газа в промышленных и энергетических установках, в сборнике: Теория и практика сжигания газа, в. 3-4, Л., 1967-68; Рябцев И. И., Волков А. Е., Производство газа из жидких топлив для синтеза аммиака и спиртов. М., 1968.
В. А. Спейшер.
III
Га́зы
в металлах. Г. попадают в твердые и жидкие металлы при их выплавке и электролитическом получении, при взаимодействии металлических изделий с атмосферой. Например, при производстве стали из чугуна в мартеновских печах или в конверторах в расплавленный металл из печной атмосферы попадают кислород и азот; при получении никеля электролизом его водных растворов твёрдый металл насыщается водородом, выделяющимся на катоде. Различают 3 вида взаимодействия межу Г. и металлами: адсорбцию (См.
Адсорбция), растворение и образование химических соединений.
При адсорбции Г. взаимодействуют только с поверхностью металла и образуют на ней плёнки толщиной, равной диаметру одной или несколько молекул. Адсорбция уменьшается при повышении температуры и понижении давления Г. над металлом. Г., адсорбированные на металлических частях электровакуумных приборов (применяемых в измерительной аппаратуре), радиопередающих устройств, преобразователей электрической энергии, в процессе эксплуатации десорбируются и нарушают устойчивую работу аппаратуры (например, изменяют электропроводность). Удаление адсорбированных Г. при изготовлении такой аппаратуры достигается глубокой откачкой, применением поглотителей Г. (геттеров (См.
Геттеры)) и является одной из важнейших задач вакуумной техники.
Большинство Г., кроме инертных, образует с твёрдыми и жидкими металлами истинные растворы. Г., молекулы которых состоят из нескольких атомов (например, сернистый газ, углекислый газ, водород, азот), при растворении в металлах распадаются на атомы. Это облегчает внедрение Г. в металл, т. к. уменьшает энергию, необходимую для того, чтобы раздвинуть сильно взаимодействующие друг с другом атомы металла. Кроме того, часть затрачиваемой энергии компенсируется её выигрышем при химическом взаимодействии атомов Г. и металла. Поэтому растворение многоатомных газов сопровождается их диссоциацией (См.
Диссоциация). Например, двухатомные газы водород и азот растворяются в железе по реакциям
H2 = 2Нв железе; N2" = 2Nв железе.
Растворимость Г. в расплавленных металлах значительно выше, чем в твёрдых. Это часто приводит к ухудшению качества металлических слитков из-за образования в них газовых пузырей, внутренних раковин и пористости. Такие дефекты возникают вследствие того, что при постепенном затвердевании слитка (кристаллизации) в изложнице концентрация Г. в остающейся жидкости настолько повышается, что Г. выделяются в ее объеме, а образующиеся при этом пузыри не успевают всплыть и удалиться до полного затвердевания слитка.
Г. часто образуют с металлами химические соединения: окислы, сульфиды, нитриды. Эти соединения нерастворимы в металлах и выделяются в виде самостоятельных фаз - т. н. неметаллических включений, присутствие которых сильно ухудшает механические и антикоррозионные свойства металлов и сплавов. Поэтому в промышленности применяются различные способы удаления Г. из металлов. Один из наиболее эффективных - использование вакуумирования. При этом благодаря понижению давления Г. происходит их выделение из металлов, протекающее особенно интенсивно, когда металл находится в расплавленном состоянии.
Широко распространены выплавка металлов и сплавов, особенно стали, в вакуумных печах, вакуумирование жидкого металла при разливке и в ковшах (см.
Вакуумная плавка,
Дегазация стали). С такой же целью применяют продувку жидкого металла инертными газами (например, аргоном). В ряде случаев осуществляют плавку или нагрев металла в защитной газовой атмосфере, не содержащей компонентов, вредных для металла.
Лит.: Смителлс К., Газы и металлы, пер. с англ., М. - Л., 1940; Вакуумная металлургия, М., 1962; Жуховицкий А. А., Шварцман Л. А., Физическая химия, М., 1963; Дэшман С., Научные основы вакуумной техники, пер. с англ., М., 1964.
Л. А. Шварцман, Л. В. Ванюкова.


![NO<sub>2</sub>]] NO<sub>2</sub>]]](https://commons.wikimedia.org/wiki/Special:FilePath/Diossido di azoto.jpg?width=200)
