Entrez un mot ou une phrase dans n'importe quelle langue 👆
Langue:
Traduction et analyse de mots par intelligence artificielle ChatGPT
Sur cette page, vous pouvez obtenir une analyse détaillée d'un mot ou d'une phrase, réalisée à l'aide de la meilleure technologie d'intelligence artificielle à ce jour:
- comment le mot est utilisé
- fréquence d'utilisation
- il est utilisé plus souvent dans le discours oral ou écrit
- options de traduction de mots
- exemples d'utilisation (plusieurs phrases avec traduction)
- étymologie
Qu'est-ce (qui) est Стандартные состояния - définition
Стандартные состояния
условно принятые термодинамические состояния индивидуальных веществ и компонентов растворов. Представление о С. с. введено в связи с тем, что простые термодинамические закономерности не описывают достаточно точно поведение реальных веществ, когда количественной характеристикой служит давление р или концентрация с. Термодинамические уравнения для идеальных газов (См. Идеальный газ) и растворов (См. Растворы) можно применять к реальным системам, если вместо давления р использовать Фугитивность f, а вместо концентрации с - Активность а. Отсчёт а и f принято начинать для всех веществ в их С. с.
С. с. газа при каждой температуре - это гипотетическое состояние идеального газа, когда f = р = 1 и газ обладает свойствами, присущими реальному газу при бесконечно малом давлении. Для жидких и кристаллических индивидуальных веществ в качестве С. с. при каждой температуре принимается их состояние под нормальным давлением. В случае растворов за С. с. для растворителя обычно принимают состояние чистого растворителя, а для растворённого вещества - его состояние в бесконечно разбавленном растворе, когда для него а = с (обычно с - мольная доля или молярность; см. Концентрация). Изменения термодинамических параметров - гиббсовой энергии (См. Гиббсова энергия), энтропии (См. Энтропия) и др. - для какого-либо процесса, вычисляемые с помощью f или а, не зависят от выбора С. с. при условии, что в данном расчёте оно неизменно для всех начальных и конечных состояний. К символам, обозначающим свойства вещества (характеристики процесса) в С. с., добавляется знак градуса как верхний индекс (например, ΔН°обр - стандартная энтальпия образования какого-либо вещества).
Представления о С. с. широко используются в физической химии. При сравнении термодинамических функций (см. Термодинамика химическая) и проведении термохимических расчётов (например, на основе Гесса закона) необходимо, чтобы все тепловые эффекты реакций были отнесены к одинаковым условиям, т.к. они зависят от температуры (в меньшей степени от давления), а для реакций в растворах - от концентрации. В термохимии (См. Термохимия) в качестве С. с. принимают состояние веществ, в котором они находятся при 298,15 К и р = 1 атм (760 мм рт. ст.). Следует отметить, что возможность существования вещества в С. с. не обязательна; так, в расчётах может фигурировать теплота образования газообразной H2O в С. с., хотя подобное состояние, для водяного пара при р = 1 атм и 25 С термодинамически невозможно.
Лит.: Карапетьянц М. Х., Химическая термодинамика, 3 изд., М., 1975.
Стандартные состояния
Станда́ртные состоя́ния — в химической термодинамике условно принятые состояния индивидуальных веществ и компонентов растворов при оценке термодинамических величин.
Термические коэффициенты
величины, характеризующие изменение какого-либо параметра, входящего в термическое Уравнение состояния термодинамической системы (объёма V, давления р), в зависимости от др. параметра (давления р, температуры Т) в определённом термодинамическом процессе. Различают изотермический коэффициент сжатия (изотермическая сжимаемость) 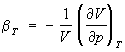 ; адиабатный коэффициент сжатия (адиабатическая сжимаемость)
; адиабатный коэффициент сжатия (адиабатическая сжимаемость) 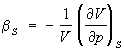 ; изохорный коэффициент давления
; изохорный коэффициент давления 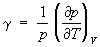 и изобарный коэффициент расширения (коэффициент объёмного расширения)
и изобарный коэффициент расширения (коэффициент объёмного расширения) 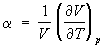 .
.
Wikipédia
Стандартные состояния
Станда́ртные состоя́ния — в химической термодинамике условно принятые состояния индивидуальных веществ и компонентов растворов при оценке термодинамических величин.


