Inserisci una parola o una frase in qualsiasi lingua 👆
Lingua:
Traduzione e analisi delle parole tramite l'intelligenza artificiale ChatGPT
In questa pagina puoi ottenere un'analisi dettagliata di una parola o frase, prodotta utilizzando la migliore tecnologia di intelligenza artificiale fino ad oggi:
- come viene usata la parola
- frequenza di utilizzo
- è usato più spesso nel discorso orale o scritto
- opzioni di traduzione delle parole
- esempi di utilizzo (varie frasi con traduzione)
- etimologia
Cosa (chi) è Металлы - definizione
ЭЛЕМЕНТ, МАТЕРИАЛ, ПРОВОДНИК ТОКА И ЭЛЕКТРИЧЕСТВА
Металл
МЕТАЛЛЫ
(греч.), вещества, обладающие в обычных условиях высокими электропроводностью (106-107 Ом-1 см-1, уменьшается с ростом температуры) и теплопроводностью, ковкостью, "металлическим" блеском и др. свойствами, обусловленными наличием в их кристаллической решетке большого количества (1022-1023 в 1 см3) слабо связанных с атомными ядрами подвижных электронов. Металлы можно представить в виде ионного кристаллического остова, погруженного в электронный газ, который, компенсируя электростатическое отталкивание ионов, связывает их в твердое тело (металлическая связь). Металлическими свойствами обладают более 80 химических элементов и множество сплавов. Химические свойства металлов обусловлены слабой связью валентных электронов с ядрами атомов: они легко образуют положительные ионы, проявляют положительную степень окисления, образуют основные оксиды и гидрооксиды, большинство металлов замещает водород в кислотах и т. д. Металлы принято делить на черные (Fe и сплавы на его основе) и цветные (все остальные). Металлы играют огромную роль главным образом как конструкционные и электротехнические материалы.
Металлы
простые вещества, обладающие в обычных условиях характерными свойствами: высокой электропроводностью и теплопроводностью, отрицательным температурным коэффициентом электропроводности, способностью хорошо отражать электромагнитные волны (блеск и непрозрачность), пластичностью. М. в твёрдом состоянии имеют кристаллическое строение. В парообразном состоянии М. одноатомны.
Перечисленные выше характерные свойства М. обусловлены их электронным строением. Атомы М. легко отдают внешние (валентные) электроны. В кристаллической решётке М. не все электроны связаны со своими атомами. Некоторая их часть (Металлы 1 на атом) подвижна. Эти электроны могут более или менее свободно перемещаться по М. Существование свободных электронов (электронов проводимости) в М. объясняется зонной теорией (см. Твёрдое тело). М. можно представить себе в виде остова из положительных ионов, погруженного в "электронный газ". Последний компенсирует силы электростатического отталкивания между положительными ионами и тем самым связывает их в твёрдое тело (металлическая связь).
Из известных (1974) 105 химических элементов 83 - М. и лишь 22 - Неметаллы. Если в длинном или "полудлинном" варианте периодической системы элементов (См. Периодическая система элементов) Менделеева провести прямую линию от бора до астата (табл. 1), то можно считать, что неметаллы расположены на этой линии и справа от неё, а М. - слева.
Не следует, однако, абсолютизировать ни свойства, характерные для М., ни их отличия от неметаллов. Металлический блеск присущ только компактным металлическим образцам. Тончайшие листки Ag и Au (толщиной 10-4 мм) просвечивают голубовато-зелёным цветом. Мельчайшие порошки М. часто имеют чёрный или черно-серый цвет. Некоторые металлы (Zn, Sb, Bi) при комнатной температуре хрупки и становятся пластичными только при нагревании.
Вся совокупность перечисленных выше свойств присуща типичным М. (например, Cu, Au, Ag, Fe) при обычных условиях (атмосферном давлении, комнатной температуре). При очень высоких давлениях (Металлы 105-106 ам) свойства М. могут существенно измениться, а неметаллы приобрести металлические свойства.
Многие простые вещества по одним свойствам можно отнести к М., по др. - к неметаллам. Особенно много такого рода "нарушений" имеет место вблизи границы, проведённой в табл. 1. Так, Ge по внешнему виду - М., в химическом отношении проявляет себя скорее как М. (легче отдаёт электроны, чем принимает), а по величине и характеру электропроводности Ge - полупроводник. Сурьма Sb имеет электросопротивление слишком большое для М., однако температурный коэффициент сопротивления у Sb положительный и большой, как у М.; по способности отдавать электроны Sb также относится к М. As, Sb и Bi иногда называют полуметаллами (См. Полуметаллы). Po по внешнему виду - М., в химическом отношении ему присущи свойства и М., и неметалла - наряду с положительной валентностью (точнее окислительным числом) проявляется и отрицательная (- 2).
Металлические сплавы по свойствам имеют много общего с М., поэтому в физической, технической и экономической литературе нередко к М. относят также и Сплавы.
Историческая справка. Термин "металл" произошёл от греческого слова métallon (от metalléuo - выкапываю, добываю из земли), которое означало первоначально копи, рудники (в этом смысле оно встречается у Геродота, 5 в. до н. э.). То, что добывалось в рудниках, Платон называл metalléia. В древности и в средние века считалось, что существует только 7 М.: золото, серебро, медь, олово, свинец, железо, ртуть (см. Знаки химические). По алхимическим представлениям, М. зарождались в земных недрах под влиянием лучей планет и постепенно крайне медленно совершенствовались, превращаясь в серебро и золото (см. Алхимия). Алхимики полагали, что М. - вещества сложные, состоящие из "начала металличности" (ртути) и "начала горючести" (серы). В начале 18 в. получила распространение гипотеза, согласно которой М. состоят из земли и "начала горючести" - флогистона. М. В. Ломоносов насчитывал 6 М. (Au, Ag, Cu, Sn, Fe, Pb) и определял М. как "светлое тело, которое ковать можно". В конце 18 в. А. Л. Лавуазье опроверг гипотезу флогистона и показал, что М. - простые вещества. В 1789 Лавуазье в руководстве по химии дал список простых веществ, в который включил все известные тогда 17 М. (Sb, Ag, As, Bi, Со, Cu, Sn, Fe, Mn, Hg, Mo, Ni, Au, Pt, Pb, W, Zn). По мере развития методов химического исследования число известных М. возрастало. В 1-й половине 19 в. были открыты спутники Pt, получены путём электролиза некоторые щелочные и щёлочноземельные М., положено начало разделению редкоземельных металлов, открыты неизвестные М. при химическом анализе минералов. В 1860-63 методом спектрального анализа были открыты Cs, Rb, Tl, In. Блестяще подтвердилось существование М., предсказанных Д. И. Менделеевым на основе его периодического закона. Открытие радиоактивности (См. Радиоактивность) в конце 19 в. повлекло за собой поиски природных радиоактивных М., увенчавшиеся полным успехом. Наконец, методом ядерных превращений начиная с середины 20 в. были искусственно получены радиоактивные М., в частности Трансурановые элементы.
В конце 19 - начале 20 вв. получила физико-химическую основу металлургия - наука о производстве М. из природного сырья. Тогда же началось исследование свойств М. и их сплавов в зависимости от состава и строения (см. Металловедение, Металлофизика).
Химические свойства. В соответствии с местом, занимаемым в периодической системе элементов (табл. 1), различают М. главных и побочных подгрупп. М. главных подгрупп (подгруппы а) называют также непереходными. Эти М. характеризуются тем, что в их атомах происходит последовательное заполнение s- и р-электронных оболочек. В атомах М. побочных подгрупп (подгруппы б), называют переходными, происходит достраивание d- и f-оболочек, в соответствии с чем их делят на d-группу и две f-группы - Лантаноиды и Актиноиды. В подгруппы а входят 22 М.: Li, Na, К, Rb, Cs, Fr (I a); Be, Mg, Ca, Sr, Ba, Ra (II a); Al, Ga, In, Tl (III a); Ge, Sn, Pb (IV a); Sb, Bi (V a); Po (VI а). В подгруппы б входят: 1) 33 переходных металла d-группы [Cu, Ag, Au (I б), Zn, Cd, Hg (II б); Sc, Y, La, Ac (III б); Ti, Zr, Hf, Ku (IV б); V, Nb, Ta, элемент с Z = 105 (V б), Cr, Mo, W (VI б), Mn, Te, Re (VII б), Fe, Co, Ni, Ru, Rh, Pd, 0s, lr, Pt (VIII б)]; 2) 28 М. f-группы (14лантаноидов и 14 актиноидов).
Электронная структура атомов некоторых d-элементов имеет ту особенность, что один из электронов внешнего уровня переходит на d-подуровень. Это происходит при достройке этого подуровня до 5 или 10 электронов. Поэтому электронная структура валентных подуровней атомов d-элементов, находящихся в одной подгруппе, не всегда одинакова. Например, Cr и Mo (подгруппа VI б) имеют внешнюю электронную структуру соответственно 3d54s1 и 4d55s1, тогда как у W она 5d46s2. В атоме Pd (подгруппа VIII б) два внешних электрона "перешли" на соседний валентный подуровень, и для атома Pd наблюдается d10 вместо ожидаемого d8s2.
М. присущи многие общие химические свойства, обусловленные слабой связью валентных электронов с ядром атома: образование положительно заряженных ионов (катионов), проявление положительной валентности (окислительного числа), образование основных окислов и гидроокисей, замещение водорода в кислотах и т.д. Металлические свойства элементов можно сравнить, сопоставляя их электроотрицательность [способность атомов в молекулах (в ковалентной связи) притягивать электроны, выражена в условных единицах]; элементу присущи свойства М. тем больше, чем ниже его электроотрицательность (чем сильнее выражен электроположительный характер).
В периодической системе элементов (См. Периодическая система элементов) Менделеева (табл. 1) в пределах каждого периода, начиная со 2-го, с увеличением атомного номера электроотрицательность возрастает от 2 до 7, начиная со щелочного металла и кончая галогеном (переход от М. к неметаллам). В пределах подгрупп (а и б) с увеличением атомного номера электроотрицательность в общем уменьшается, хотя и не всегда последовательно. В семействах лантаноидов и актиноидов она сохраняется примерно на одном уровне.
Если расположить М. в последовательности увеличения их нормальных потенциалов (См. Нормальный потенциал), получим т. н. ряд напряжений или Ряд активностей (табл. 2 и 3). Рассмотрение этого ряда показывает, что по мере приближения к его концу - от щелочных и щёлочноземельных М. к Pt и Au - электроположительный характер членов ряда уменьшается. М. от Li по Na вытесняют H2 из H2O на холоду, а от Mg по Tl - при нагревании. Все М., стоящие в ряду выше H2, вытесняют его из разбавленных кислот (на холоду или при нагревании). М., стоящие ниже H2, растворяются только в кислородных кислотах (таких, как концентрированная H2SO4 при нагревании или HNO3), а Pt, Au - только в царской водке (Ir нерастворим и в ней).
М. от Li по Na легко реагируют с O2 на холоду; последующие члены ряда соединяются с O2 только при нагревании, а lr, Pt, Au в прямое взаимодействие с O2 не вступают.
Окислы М. от Li по Al (табл. 2) и от La по Zn (табл. 3) трудно восстановимы; по мере продвижения к концу ряда восстановимость окислов увеличивается, а окислы последних его членов разлагаются на М. и O2 уже при слабом нагревании. О прочности соединений М. с кислородом (и др. неметаллами) можно судить и по разности их электроотрицательностей (табл. 1): чем она больше, тем прочнее соединение.
Табл. 2. - Нормальные электродные потенциалы непереходных металлов
Табл. 3. - Нормальные электродные потенциалы переходных металлов
Валентности (точнее, окислительные числа) непереходных М. равны: +1 для подгруппы I а; +2 для II a; +1 и +3 для III a; +2 и +4 для IV a; +2, +3 и +5 для V a; - 2, +2, +4, +6 для VI a. У переходных М. наблюдается ещё большее разнообразие окислительных чисел: +1, +2, +3 для подгруппы I б, +2 для II б; +3 для III б; +2, +3, +4 для IV б; +2, +3, +4, +5 для V б; +2, +3, +4, +5, +6 для VI б, +2, +3, +4, +5, +6, +7 для VII б, от +2 до +8 в VIII б. В семействе лантаноидов наблюдаются окислительные числа +2, +3 и +4, в семействе актиноидов - от +3 до +6. Низшие окислы М. обладают основными свойствами, высшие являются ангидридами кислот (см. Кислоты и основания). М., имеющие переменную валентность (например, Cr, Mn, Fe), в соединениях, отвечающих низшим степеням окисления [Cr (+2), Mn (+2), Fe (+2)], проявляют восстановительные свойства; в высших степенях окисления те же М. [Cr (+6), Mn (+7), Fe (+3)] обнаруживают окислительные свойства. О химических соединениях М. друг с другом см. в ст. Металлиды, о соединениях М. с неметаллами см. в статьях Бориды, Гидриды, Карбиды, Нитриды, Окислы и др.
Лит.: Некрасов Б. В., Основы общей химии, 2 изд., т. 1-3, М., 1969-70; Дей М. К., Селбин Дж., Теоретическая неорганическая химия, пер. с англ., 2 изд., М., 1971; Барнард А., Теоретические основы неорганической химии, пер. с англ., М., 1968; Рипан Р., Четяну И., Неорганическая химия, т. 1-2, Химия металлов, пер. с рум., М., 1971-72. См. также лит. при ст. Неорганическая химия.
С. А. Погодин.
Физические свойства. Большинство М. кристаллизуется в относительно простых структурах - кубических (кубические объёмноцентрированная ОЦК и гранецентрированная ГЦК решётки) и гексагональных ПГУ, соответствующих наиболее плотной упаковке атомов. Лишь небольшое число М. имеет более сложные типы кристаллических решёток. Многие М. в зависимости от внешних условий (температуры, давления) могут существовать в виде двух или более кристаллических модификаций (см. Полиморфизм). Полиморфные превращения иногда связаны с потерей металлических свойств, например превращение белого олова (β-Sn) в серое (α-Sn).
Электрические свойства. Удельная электропроводность М. при комнатной температуре σ Металлы 10-6-10-4 ом-1см-1 (табл. 1), тогда как у диэлектриков (См. Диэлектрики), например у серы, σ Металлы 10-17 ом-1см-1. Промежуточные значения σ соответствуют полупроводникам (См. Полупроводники). Характерным свойством М. как проводников электрического тока является линейная зависимость между плотностью тока и напряжённостью приложенного электрического поля (Ома закон). Носителями тока в М. являются электроны проводимости, обладающие высокой подвижностью. Согласно квантово-механическим представлениям, в идеальном кристалле (См. Идеальный кристалл) электроны проводимости (при полном отсутствии тепловых колебаний кристаллической решётки (См. Колебания кристаллической решётки)) вообще не встречают сопротивления на своём пути. Существование у реальных М. электросопротивления является результатом нарушения периодичности кристаллической решётки. Эти нарушения могут быть связаны как с тепловым движением атомов, так и с наличием примесных атомов, вакансий (См. Вакансия), дислокаций (См. Дислокации) и др. дефектов в кристаллах (См. Дефекты в кристаллах). На тепловых колебаниях и дефектах (а также друг на друге) происходит рассеяние электронов. Мерой рассеяния служит длина свободного пробега - среднее расстояние l между двумя последовательными столкновениями электронов. Величина удельной электропроводности σ связана с длиной свободного пробега l соотношением:
σ = nel/pF, (1)
где n - концентрация электронов проводимости (Металлы1022-1023 см-3), е - заряд электрона, pF = 2πh (3n/8π)1/3 - граничный фермиевский импульс (см. Ферми поверхность), h - Планка постоянная. Зависимость а или удельного электросопротивления р от температуры Т связана с зависимостью l от Т. При комнатных температурах в М. l Металлы 10-6 см.
При температурах, значительно превышающих Дебая температуру (См. Дебая температура), сопротивление ρ обусловлено главным образом тепловыми колебаниями кристаллической решётки и возрастает с температурой линейно:
ρ = ρост (1 + αТ). (2)
Постоянная α называется температурным коэффициентом электропроводности и имеет при температуре Т = 0 °C типичное значение α = 4․10-5 град--1. При более низких температурах, когда влиянием тепловых колебаний атомов на рассеяние электронов можно пренебречь, сопротивление практически перестаёт зависеть от температуры. Это предельное значение сопротивления называется остаточным. Величина ρост характеризует концентрацию дефектов в решётке М. Удаётся получить столь чистые (сверхчистые) и свободные от дефектов М., что их остаточное сопротивление в 104-105 раз превышает сопротивление этих М. в обычных условиях. Длина свободного пробега электронов в сверхчистых М. l Металлы 10-2 см. Теоретическое рассмотрение показывает, что при низких температурах формула для удельного электросопротивления имеет вид:
ρ=ρост+АТ2+ВТ5 (3)
где А и В - величины, не зависящие от Т. Член BT5 связан с рассеянием электронов на тепловых колебаниях атомов, а член AT2 - со столкновениями электронов друг с другом и даёт заметный вклад в сопротивление лишь у некоторых М., например у Pt. Однако закономерность (3) выполняется лишь приближённо.
У некоторых М. и металлидов (См. Металлиды) при определённой температуре, называемой критической, наблюдается полное исчезновение сопротивления - переход в сверхпроводящее состояние (см. Сверхпроводимость). Критические температуры чистых металлов лежат в интервале от сотых долей К до 9 К (табл. 1).
Если металлический образец, по которому течёт ток, поместить в постоянное магнитное поле, то в М. возникают явления, обусловленные искривлением траекторий электронов в магнитном поле в промежутке между столкновениями (Гальваномагнитные явления). Среди них важное место занимают Холла эффект и изменение электросопротивления М. в магнитном поле (Магнетосопротивление). Влияние магнитного поля тем больше, чем больше длина свободного пробега l, т. е. чем ниже температура и чем меньше примесей в М. При комнатной температуре магнитное поле 107-105 э изменяет сопротивление М. лишь на доли \%. При T ≤ 4 К в сверхчистых М. сопротивление может измениться во много раз. Зависимость электросопротивления М. от внешнего магнитного поля существенно зависит от характера энергетического спектра электронов, в частности от формы поверхности ферми. У многих металлических Монокристаллов (Au, Cu, Ag и др.) наблюдается сложная Анизотропия сопротивления в магнитном поле.
В магнитных полях Металлы 104-105 э и при низких температурах у всех металлических монокристаллов наблюдается осциллирующая зависимость электросопротивления от магнитного поля (Шубникова - де Хааза эффект). Это явление - следствие квантования движения электронов в плоскости, перпендикулярной направлению магнитного поля. Как правило, квантовая осциллирующая зависимость в виде небольшой "ряби" наложена на обычную зависимость сопротивления от магнитного поля.
При нагревании М. до высоких температур наблюдается "испарение" электронов с поверхности М. (Термоэлектронная эмиссия). Число электронов, вылетающих в единицу времени, определяется законом: nМеталлыexp (-φ/kT), где k - Больцмана постоянная, φ - Работа выхода электронов из М. (см. Ричардсона формула). Величина φ различна у разных М. и зависит также от состояния поверхности. Эмиссия электронов с поверхности М. происходит также под действием сильных электрических полей Металлы107 в/см в результате туннельного просачивания электронов через сниженный полем потенциальный барьер (см. Туннельная эмиссия). В М. наблюдаются явления фотоэлектронной эмиссии (См. Фотоэлектронная эмиссия), вторичной электронной эмиссии (См. Вторичная электронная эмиссия) и ионно-электронной эмиссии (См. Ионно-электронная эмиссия). Перепад температуры вызывает в М. появление электрического тока или разности потенциалов (см. Термоэлектрические явления).
Тепловые свойства. Теплоёмкость М. (табл. 1) обусловлена как ионным остовом (решёточная теплоёмкость Ср), так и электронным газом (электронная теплоёмкость Сэ). Хотя концентрация электронов проводимости в М. очень велика (см. выше) и не зависит от температуры, электронная теплоёмкость мала и у большинства М. наблюдается только при температурах Металлы нескольких К. Возможность измерения Сэ связана с тем, что при уменьшении температуры Ср убывает пропорционально T3, а Сэ Металлы Т. Для Cu: Сэ = 0,9․10-4RT, для Pd: Сэ = 1,6․10-3RT (R - газовая постоянная). Теплопроводность М. осуществляется главным образом электронами проводимости. Поэтому между удельными коэффициентами электропроводности и теплопроводности существует простое соотношение, называемое Видемана - Франца законом.
Взаимодействие М. с электромагнитными полями. Переменный электрический ток при достаточно высокой частоте течёт по поверхности М., не проникая в его толщу (см. Скин-эффект). Электромагнитное поле частоты ω проникает в М. лишь на глубину скин-слоя толщиной δ.
Например, для Cu при (ω = 108 гц δ = 6․10-4 см. В таком слое поглощается незначительная часть электромагнитной энергии. Основная часть энергии переизлучается электронами проводимости и отражается (см. Металлооптика). В чистых М. при низких температурах длина свободного пробега электронов l часто превышает глубину δ. При этом напряжённость поля существенно изменяется на длине свободного пробега, что проявляется в характере отражения электромагнитных волн от поверхности М. (аномальный скин-эффект).
Сильное постоянное магнитное поле существенно влияет на электродинамические свойства М. В М., помещенных в такое поле, при условии, если частота электромагнитного поля кратна частоте прецессии электронов проводимости вокруг силовых линий постоянного магнитного поля, наблюдаются резонансные явления (см. Циклотронный резонанс). При определённых условиях в толще М., находящегося в постоянном магнитном поле, могут распространяться слабо затухающие электромагнитные волны, т. е. исчезает скин-эффект. Электродинамические свойства М., помещенного в магнитное поле, сходны со свойствами плазмы (См. Плазма) в магнитном поле и являются одним из основных источников информации об электронах проводимости.
Для электромагнитных волн оптического диапазона М., как правило, практически непрозрачны и обладают характерным блеском (см. Отражение света, Зеркало). В поглощении света в видимом и ультрафиолетовом диапазонах некоторую роль играет внутренний Фотоэффект. Отражение от поверхности М. плоскополяризованного света, падающего под произвольным углом, сопровождается поворотом плоскости поляризации и появлением эллиптической поляризации (см. Вращение плоскости поляризации). Это явление используется для определения оптических констант М.
Общая структура характеристических рентгеновских спектров М. и диэлектриков одинакова. Тонкая же структура линий, соответствующая квантовым переходам электронов из зоны проводимости на глубокие уровни, отражает распределение электронов проводимости по уровням энергии.
Магнитные свойства. Переходные металлы с недостроенными f- и d-электронными оболочками являются Парамагнетиками. Некоторые из них при определённых температурах переходят в магнитоупорядоченное состояние (см. Магнетизм, Ферромагнетизм, Антиферромагнетизм, Кюри точка). Магнитное упорядочение существенно влияет на все свойства М., в частности на электрические свойства: в электросопротивление вносит вклад рассеяние электронов на колебаниях магнитных моментов. Гальваномагнитные явления при этом также приобретают специфические черты.
Магнитные свойства остальных М. определяются электронами проводимости, которые вносят вклад в диамагнитную и парамагнитную восприимчивости М., и диамагнитной восприимчивостью ионного состава (см. Диамагнетизм, Парамагнетизм). Магнитная восприимчивость χ большинства М. относительно мала (χ Металлы 10-6) и слабо зависит от температуры.
При низких температурах Т и в больших магнитных полях Н ≥ 104 kT у всех металлических монокристаллов наблюдается сложная осциллирующая зависимость суммарного магнитного момента от поля Н (см. Де Хааза - ван Альфена эффект), природа которого та же, что и у эффекта Шубникова - де Хааза. Исследование осцилляционных эффектов позволяет определить форму поверхности Ферми.
Механические свойства. Многие М. обладают комплексом механических свойств, обеспечивающим их широкое применение в технике, в частности в качестве конструкционных материалов (См. Конструкционные материалы). Это, в первую очередь, сочетание высокой пластичности (См. Пластичность) со значительной Прочностью и сопротивлением деформации, причём соотношение этих свойств может регулироваться в большом диапазоне с помощью механической и термической обработки М., а также получением сплавов различного состава.
Исходной характеристикой механических свойств М. является модуль упругости (См. Модули упругости) G, определяющий сопротивление кристаллической решётки упругому деформированию и непосредственно отражающий величину сил связи в кристалле. В монокристаллах эта величина, как и остальные механические характеристики, анизотропна и коррелирует с температурой плавления М. (например, средний модуль сдвига G изменяется от 0,18․1011 эрг/см3 для легкоплавкого Na до 27․1011 эрг/см3 для тугоплавкого Re).
Сопротивление разрушению или пластической деформации идеального кристалла Металлы 10-1 G. Но в реальных кристаллах эти характеристики, как и все механические свойства, определяются наличием дефектов, в первую очередь дислокаций. Перемещение дислокаций по плотноупакованным плоскостям приводит к элементарному акту скольжения - основному механизму пластической деформации М. Др. механизмы Двойникование и сбросообразование) существенны только при пониженных температурах. Важнейшая особенность М. - малое сопротивление скольжению дислокации в бездефектном кристалле. Это сопротивление особенно мало в кристаллах с чисто металлической связью, которые обычно имеют плотноупакованные структуры (гранецентрированную кубическую или гексагональную). В М. с ковалентной компонентой межатомной связью, имеющих объёмноцентрированную решётку, сопротивление скольжению несколько больше, однако всё же мало по сравнению с чисто ковалентными кристаллами. Сопротивление пластической деформации, по крайней мере в М. с гранецентрированной кубической и гексагональной решётками, связано с взаимодействием движущихся дислокаций с др. дефектами в кристаллах, с др. дислокациями, примесными атомами, внутренними поверхностями раздела. Взаимодействие дефектов определяется искажениями решётки вблизи них и пропорционально G. Для отожжённых монокристаллов начальное сопротивление пластической деформации (предел текучести) обычно Металлы 10-3-10-4 G. В процессе деформации число дислокаций в кристаллической решётке (плотность дислокаций β) увеличивается от 106-108 до 1012 см-2. Соответственно растет сопротивление пластической деформации 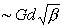 (d - межатомное расстояние). Это называют деформационным упрочнением или наклёпом. Для монокристаллов М. характерно наличие трёх стадий деформационного упрочнения. На 1-й стадии значительная часть дислокаций выходит на поверхность и коэффициент упрочнения Θ (коэффициент пропорциональности между напряжением и деформацией) мал; на 2-й стадии дислокации накапливаются в кристалле, их распределение становится существенно неоднородным: ΘМеталлыG/300. На 3-й стадии β, G и Θ уменьшаются вследствие аннигилляции дислокаций, выдавливаемых из их плоскостей скольжения. Значение этой стадии больше для М. с объёмноцентрированной решёткой.
(d - межатомное расстояние). Это называют деформационным упрочнением или наклёпом. Для монокристаллов М. характерно наличие трёх стадий деформационного упрочнения. На 1-й стадии значительная часть дислокаций выходит на поверхность и коэффициент упрочнения Θ (коэффициент пропорциональности между напряжением и деформацией) мал; на 2-й стадии дислокации накапливаются в кристалле, их распределение становится существенно неоднородным: ΘМеталлыG/300. На 3-й стадии β, G и Θ уменьшаются вследствие аннигилляции дислокаций, выдавливаемых из их плоскостей скольжения. Значение этой стадии больше для М. с объёмноцентрированной решёткой.
Степень "привязанности" дислокации к плоскости скольжения определяется шириной дислокации в этой плоскости, которая, в свою очередь, зависит от энергии γ дефекта упаковки (величина γ/Gd в М. с гранецентрированной решёткой изменяется от 10-2 для Al, имеющего узкие дислокации, до 10-4 для сплавов Cu с широкими дислокациями). Процесс разрядки дислокационной плотности ускоряется при повышении температуры и может привести к релаксации и значительному восстановлению свойств кристаллов. Чем выше температура и меньше скорость деформирования, тем больше успевают развиться процессы релаксации и тем меньше деформационное упрочнение.
При Т > 0,5 Тпл в пластической деформации начинают играть существенную роль точечные дефекты, в первую очередь вакансии, которые, оседая на дислокациях, приводят к их выходу из плоскостей скольжения. Если этот процесс достаточно интенсивен, то деформация не сопровождается упрочнением: М. течёт с постоянной скоростью при неизменной нагрузке (Ползучесть). Протекание процессов релаксации напряжений и постоянная разрядка дислокационной структуры обеспечивают высокую пластичность М. при их горячей обработке, что позволяет придавать изделиям из М. разнообразную форму. Отжиг сильно деформированных монокристаллов М. нередко приводит к образованию Поликристаллов с малой плотностью дислокаций внутри зёрен (рекристаллизация).
Достижимые степени деформации М. ограничены процессом разрушения. По мере роста плотности дислокаций при холодной деформации растёт неравномерность их распределения, приводящая к концентрации напряжений в местах сгущения дислокаций и зарождению здесь очагов разрушения - трещин. В реальных кристаллах такие концентрации напряжений имеются и в исходном недеформированном состоянии (скопление примесей, частицы др. фаз и т.п.). Но вследствие пластичности М. деформация вблизи опасных мест снимает напряжения и предотвращает разрушение. Однако, если сопротивление движению дислокаций растет, то релаксационная способность материала падает, что под нагрузкой приводит к развитию трещин (хрупкое разрушение). Это особенно проявляется в М. с объёмноцентрированной решёткой, в которых подвижность дислокаций резко уменьшается при понижении температуры (из-за взаимодействия с примесями и уменьшения числа кристаллографич. возможных плоскостей скольжения). Предотвращение хладноломкости (См. Хладноломкость) - одна из важнейших технических проблем разработки конструкционных металлических материалов. Др. актуальная проблема - увеличение прочности и сопротивления деформации при высоких температурах. Зародышами разрушения в этих условиях служат микропоры, образующиеся в результате скопления вакансий. Эффективный способ повышения высокотемпературной прочности - уменьшение диффузионной подвижности точечных дефектов, в частности Легированием.
Применяемые в технике конструкционные металлические материалы являются поликристаллическими. Их механические свойства практически изотропны и могут существенно отличаться от свойств монокристаллов М. Межфазные границы вносят дополнительный вклад в упрочнение. С др. стороны, они могут быть местами предпочтительного разрушения (межзёренное разрушение) или деформации. Изменяя число и строение межфазных границ, форму и пространственное расположение отдельных структурных составляющих многофазных систем (поликристаллов, гетерофазных агрегатов, возникающих вследствие фазовых превращений, или искусственно полученных композиций), а также регулируя состав и дефектную структуру отдельных кристаллов, можно получить огромное разнообразие механических свойств, необходимых для практического использования металлических материалов.
А. Л. Ройтбурд.
Лит.: Френкель Я. И., Введение в теорию металлов, 2 изд., М. - Л., 1950; Бете Г., Зоммерфельд А., Электронная теория металлов, пер. с нем., М. - Л., 1938; Лифшиц И. М., Азбель М. Я., Каганов М. И., Электронная теория металлов, М., 1971; Абрикосов А. А., Введение в теорию нормальных металлов, М., 1972; Слэтер Дж., Диэлектрики, полупроводники, металлы, пер. с англ., М., 1969; Шульце Г., Металлофизика, пер. с нем., М., 1971.
Металлы в технике. Благодаря таким свойствам, как прочность, твёрдость, пластичность, коррозионная стойкость, жаропрочность, высокая электрическая проводимость и многое др., М. играют громадную роль в современной технике, причём число М., находящих применение, постоянно растет. Характерно, что до начала 20 в. многие важнейшие М. - Al, V, W, Mo, Ti, U, Zr и др. - либо не производились вообще, либо выпускались в очень ограниченных масштабах; такие М., как Be, Nb, Ta, начали сравнительно широко использоваться лишь накануне 2-й мировой войны 1939-45. В 70-х гг. 20 в. в промышленности применяются практически все М., встречающиеся в природе.
Все М. и образованные из них сплавы делят на чёрные (к ним относят железо и сплавы на его основе; на их долю приходится около 95\% производимой в мире металлопродукции) и цветные, или, точнее, нежелезные (все остальные М. и сплавы). Большое число нежелезных М. и широкий диапазон их свойств не позволяют классифицировать их по какому-либо единому признаку. В технике принята условная классификация, по которой эти М. разделены на несколько групп по различным признакам (физическим и химическим свойствам, характеру залегания в земной коре), специфичным для той или иной группы: Лёгкие металлы (например, Al, Mg), тяжёлые М. (Cu, Pb и др.), Тугоплавкие металлы (W, Mo и др.), Благородные металлы (Au, Pt и др.), рассеянные металлы (Ga, In, TI), редкоземельные М. (Sc, Y, La и Лантаноиды, см. Редкоземельные элементы), радиоактивные металлы (Ra, U и др.). М., которые производят и используют в ограниченных масштабах, называются редкими металлами (См. Редкие металлы). К ним относят все рассеянные, редкоземельные и радиоактивные М., большую часть тугоплавких и некоторые лёгкие М.
Большая способность М. к образованию многочисленных соединений разного типа, к различным фазовым превращениям создаёт благоприятные условия для получения разнообразных сплавов (См. Сплавы), характеризующихся требуемым сочетанием полезных свойств. Число используемых в технике сплавов превысило уже 10 тыс. Значение сплавов как конструкционных материалов (См. Конструкционные материалы), электротехнических материалов, материалов с особыми физическими свойствами (см. Прецизионные сплавы) непрерывно возрастает. В то же время в связи с развитием полупроводниковой и ядерной техники расширяется производство ряда особо чистых металлов (См. Чистые металлы) (чистотой например, 99,9999\% и выше).
Применение того или иного М. (или сплава) в значительной мере определяется практической ценностью его свойств; однако существенное значение имеют и др. обстоятельства, в первую очередь природные запасы М., доступность и рентабельность его добычи. Из наиболее ценных и важных для современной техники М. лишь немногие содержатся в земной коре в больших количествах: Al (8,8\%), Fe (4,65\%) Mg (2,1\%), Ti (0,63\%). Природные ресурсы ряда весьма важных М. измеряются сотыми долями процента (например, Cu, Mn, Cr, V, Zr) и даже тысячными долями (например, Zn, Sn, Pb, Ni, Co, Nb). Некоторые ценные М. присутствуют в земной коре в ещё меньших количествах. Так, содержание урана - важнейшего источника ядерной энергии - оценивается в 0,0003\%, вольфрама, являющегося основой твёрдых сплавов, - 0,0001\% и т.д. Особенно бедна природа благородными и т. н. редкими М.
Многообразие М. предопределяет большое число способов их получения и обработки (см. Металлургия). Взаимосвязь состава, строения и свойств металлов и сплавов, а также закономерности их изменения в результате теплового, химического или механического воздействия изучает Металловедение. О свойствах, способах получения, масштабах производства и применении отдельных М. см. в статьях, посвященных соответствующим химическим элементам и сплавам на их основе (например, Алюминий, Алюминиевые сплавы, Бериллий, Бериллиевые сплавы и т.д.).
О применении М. и их сплавов в искусстве см. в статьях Бронза, Железо, Золото, Медь, Олово, Серебро, Сталь, Чугун, Гравирование, Гравюра, Зернь, Ковка, Насечка, Тиснение, Филигрань, Чеканка, Ювелирное искусство.
И. И. Новиков.
Периодическая система Д. И. Менделеева. Свойства металлов.
Металлы
Металлы и металлоиды (хим.). - М. называется группа простых тел,обладающих известными характерными свойствами, которые в типичныхпредставителях резко отличают М. от других химических элементов. Вфизическом отношении это по большей части тела твердые при обыкновеннойтемпературе, непрозрачные (в толстом слое), обладающие известнымблеском, ковкие, тягучие, хорошие проводники тепла и электричества ипр.; в химич. отношении для них является характерной способностьюобразовывать с кислородом основные окислы, которые, соединяясь скислотами, дают соли. Знакомство человека с М. началось с золота,серебра и меди, т. е. с М., встречающимися в свободном состоянии наземной поверхности; впоследствии к ним присоединились М., значительнораспространенные в природе и легко выделяемые из их соединений: олово,свинец, железо и ртуть. Эти семь М. были знакомы человечеству в глубокойдревности. Между египетскими редкостями встречаются золотые и медныеизделия, которые, по некоторым данным, относятся к эпохе удаленной на3000 - 4000 лет от Р. Хр. К этим семи М. уже только в средние векаприбавились цинк, висмут, сурьма и в начале XVIII ст. мышьяк. С половиныXVIII ст. число М. быстро возрастает и в настоящее время доходит до 65.Ни одно из химических производств не способствовало столько развитиюхимических знаний, как процессы, связанные с получением и обработкой М.;с историей их связаны важнейшие моменты истории химии. Свойства М. такхарактерны, что уже в самую раннюю эпоху золото, серебро, медь, свинец,олово, железо и ртуть составляли одну естественную группу однородныхвеществ, и понятие о М. относится к древнейшим химическим понятиям.Однако, воззрения на их натуру в более или менее определенной формеявляются только в средние века у алхимиков. Правда, идеи Аристотеля оприроде, об образовании всего существующего из 4 элементов (огня, земли,воды и воздуха) уже тем самым указывали на сложность М.; но эти идеибыли так туманны, так абстрактны и имели так мало реального в основе! Уалхимиков понятие о сложности М. и, как результат этого, вера ввозможность превращать одни М. в другие, создавать их искусственно,является основным понятием их миросозерцания. Это понятие естьестественный вывод из той массы фактов, относящихся до химическихпревращений М., которые накопились к тому времени. В самом деле,превращение М. в совершенно непохожую на них окись простым прокаливаниемна воздухе и обратное получение М. из окиси, выделение одних М. издругих, образование сплавов, обладающих другими свойствами, чемпервоначально взятые М. и пр., все это, как будто, должно было указыватьна сложность их натуры. Что касается собственно до превращения М. взолото, то вера в возможность этого была основана на многих видимыхфактах. В первое время образование сплавов, цветом похожих на золото,напр., из меди и цинка, в глазах алхимиков уже было превращение их взолото. Им казалось, что нужно изменить только цвет и свойства М. будутдругие. В особенности много способствовали этой вере плохо поставленныеопыты, когда для превращения неблагородного М. в золото бралисьвещества, содержавшие примесь этого золота. Напр., уже в конце XVIII ст.один копенгагенский аптекарь уверял, что химически чистое серебро присплавлении с мышьяком отчасти превращается в золото. Этот факт былподтвержден изв. химиком Гитоном де Морво (Guyton de Morveau) и наделалмного шума. В скорости потом было показано, что мышьяк, служивший дляопыта, содержал следы серебра с золотом! Так как из семи известных тогдаМ. одни легче подвергались превращениям, другие труднее, то алхимикиделили их на благородные, совершенные, и неблагородные, несовершенные. Кпервым принадлежали золото и серебро, ко вторым медь, олово, свинец,железо и ртуть. Последняя, обладая свойствами благородных М., но в то жевремя резко отличаясь от всех металлов своим жидким состоянием илетучестью, чрезвычайно занимала тогдашних ученых, и некоторые выделялиее в особую группу; внимание, привлекавшееся ею, было так велико, что,как увидим далее, ртуть стали считать в числе элементов, из которыхобразованы М., и в ней именно видели носителя металлических свойств.Принимая существование в природе перехода одних М. в другие,несовершенных в совершенные, алхимики предполагали, что в обычныхусловиях это превращение идет чрезвычайно медленно, целыми веками, и,может быть, не без таинственного участия небесных светил, которым в товремя приписывали такую большую роль и в судьбе человека. По странномусовпадению, М. было числом семь, как и известных тогда планет, а это ещеболее указывало на таинственную связь между ними. У алхимиков М. частоносят название планет; золото наз. Солнцем, серебро - Луной, медь -Венерой, олово - Юпитером, свинец - Сатурном, железо - Марсом и ртуть -Меркурием. Когда были открыты цинк, висмут, сурьма и мышьяк, тела вовсех отношениях схожи с М., но у которых одно из характернейших свойствметалла, ковкость, развито в слабой степени, то они были выделены вособую группу - полуметаллов. Деление М. на собственно металлы иполуметаллы существовало еще в половине ХVIII ст. Если М. тела сложные, то что же входит в их состав. В первое времяалхимики считали, что они образованы из двух элементов - ртути и серы.Как сложилось это воззрение - сказать трудно, но его мы находим уже вVIII ст. По Geber'y доказательством присутствия ртути в М. служит то,что она их растворяет, и в этих растворах индивидуальность их исчезает,поглощается ртутью, чего не случилось бы, если бы в них не было одногообщего с ртутью начала. Кроме того ртуть со свинцом давала нечто похожеена олово. Что касается серы, то, может быть, она взята потому, что былиизвестны сернистые соединения, по внешнему виду схожие с М. В дальнейшемэти простые представления, вероятно, вследствие безуспешных попытокприготовления М. искусственно, крайне усложняются, запутываются. Впонятиях алхимиков, напр. Х - XIII ст., ртуть и сера, из которыхобразованы М. не были та ртуть и та сера, которые имели в рукахалхимики. Это было только нечто схожее с ними, обладающее особымисвойствами; нечто такое, которое в обыкновенной сере и ртутисуществовало реально, было выражено в них в большей степени, чем вдругих телах. Под ртутью, входящей в состав М., представляли нечто,обусловливающее неизменяемость их, металлический блеск, тягучесть, однимсловом, носителя металлического вида; под серой подразумевали носителяизменяемости, разлагаемости, горючести М. Эти два элемента находились вМ. в различном количестве и, как тогда говорили, различным образомфиксированные; кроме того, они могли быть различной степени чистоты. ПоГеберу, напр., золото состояло из большого количества ртути и небольшогоколичества серы высшей степени чистоты и наиболее фиксированных; волове, напротив, предполагали много серы и мало ртути, которые были нечисты, плохо фиксированы и пр. Всем этим, конечно, хотели выразитьразличное отношение М. к единственному в тогдашнее время могущественномухимическому агенту - огню. При дальнейшем развитии этих воззрений, двухэлементов - ртути и серы, - для объяснения состава М. алхимикампоказалось недостаточно; к ним присоединили соль, а некоторые мышьяк.Этим хотели указать, что при всех превращениях М. остается нечтонелетучее, постоянное. Если в природе превращение неблагородных М. вблагородные совершается веками, то алхимики стремились создать такиеусловия, в которых этот процесс совершенствования, созревания шел быскоро и легко. Вследствие тесной связи химии с тогдашней медициной итогдашней биологией идея о превращении М. естественным образомотождествлялась с идеей о росте и развитии организованных тел: переход,напр., свинца в золото, образование растений из зерна, брошенного вземлю и как бы разложившегося, брожение, исцеление больного органа учеловека, все это были частные явления одного общего таинственногожизненного процесса, совершенствования, и вызывались одними стимулами.Отсюда само собой понятно, что таинственное начало, дающее возможностьполучить золото, должно было исцелять болезни, превращать староечеловеческое тело в молодое и пр. Так сложилось понятие о чудесномфилософском камне. Что касается роли философского камня в превращениинеблагородных М. в благородные, то больше всего существует указанийотносительно перехода их в золото, о получении серебра говорится мало.По одним авторам, один и тот же философский камень превращает М. всеребро и золото; по другим - существуют два рода этого вещества: односовершенное, другое менее совершенное, и это последнее и служит дляполучения серебра. Относительно количества философского камня,требующегося для превращения, указания тоже разные. По одним, 1 ч. егоспособна превратить в золото 10000000 ч. М., по другим 100 ч. и дажетолько 2 ч. Для получения золота плавили какой-нибудь неблагородный М.или брали ртуть и бросали туда философский камень; одни уверяли, чтопревращение происходит мгновенно, Другие же - мало помалу и пр. Этивзгляды на природу М. и на способность их к превращениям держатся вобщем в течении многих веков до XVII ст., когда начинают резко отрицатьвсе это, тем более, что эти взгляды вызвали появление многих шарлатанов,эксплуатировавших надежду легковерных получить золото. С идеямиалхимиков в особенности боролся Бойль. "Я бы хотел знать - говорит он водном месте, - как можно разложить золото на ртуть, серу и соль; я готовуплатить издержки по этому опыту; что касается меня, то я никогда не могэтого достигнуть". После вековых бесплодных попыток искусственногополучения М. и при том количестве фактов, которые накопились к XVII ст.,напр. о роли воздуха при горении, увеличении веса М. при окислении, что,впрочем, знал еще Гебер, в VIII ст., вопрос об элементарности состава М.казалось был совсем близок к окончанию; но в химии появилось новоетечение, результатом которого явилась флогистонная теория, и решениеэтого вопроса было еще отсрочено на продолжительное время. Ученых тоговремени сильно занимали явления горения. Исходя из основной идеифилософии того времени, что сходство в свойствах тел должно происходитьот одинаковости начал, элементов, входящих в их состав, принимали, чтотела горючие заключают общий элемент. Акт горения считался актомразложения, распадения на элементы; при этом элемент горючести выделялсяв виде пламени, а другие оставались. Признавая взгляд алхимиков наобразование М. из 3-х элементов, ртути, серы и соли, и принимая ихреальное существование в М. горючим началом в них нужно было признатьсеру. Тогда другой составной частью М. нужно было, очевидно, признатьостаток от прокаливания М. - их землю, как тогда говорили;следовательно, ртуть тут не причем. С другой стороны, сера сгорает всерную кислоту, которую многие, в силу сказанного, считали более простымтелом, чем сера, и включили в число элементарных тел. Выходила путаницаи противоречие. Бехер, чтобы согласовать старые понятия с новыми,принимал существование в М. земли трех сортов: собственно землю, землюгорючую и землю ртутную. В этих то условиях Сталь предложил свою теорию.По его мнению, началом горючести служит не сера и не какое-либо другоеизвестное вещество, а нечто неизвестное, названное им флогистон. М.образованы из флогистона и земли; прокаливание М. на воздухесопровождается выделением флогистона; обратное получение М. из его землис помощью угля - вещества богатого флогистоном - есть акт соединенияфлогистона с землей. Хотя М. было несколько и каждый из них припрокаливании давал свою землю, последняя, как элемент, была одна, такчто и эта составная часть М. была такого же гипотетического характера,как и флогистон; впрочем, последователи Сталя иногда принимали столькоэлементарных земель, сколько было М. Когда Кавендиш при растворении М. вкислотах получил водород и исследовал его свойства (неспособностьподдерживать горение, его взрывчатость в смеси с воздухом и пр.), онпризнал в нем флогистон Сталя; М. по его понятиям, состоят из водорода иземли. Этот взгляд принимался многими последователями флогистоннойтеории. Несмотря на видимую стройность теории флогистона, существоваликрупные факты, которые никак нельзя было связать с нею. Еще Геберу былоизвестно, что М. при обжигании увеличиваются в весе; между тем, поСталю, они должны терять флогистон: при обратном присоединениифлогистона к земле вес полученного М. меньше веса земли. Таким образомвыходило, что флогистон должен обладать какимто особенным свойством -отрицательным тяготением. Несмотря на все остроумные гипотезы,высказанные для объяснения этого явления, оно было непонятно и вызывалонедоумение. Когда Лавуазье выяснил роль воздуха при горении и показал,что прибыль в весе М. при обжигании происходит от присоединения к М.кислорода воздуха, и таким образом установил, что акт горения М. есть нераспадение на элементы, а, напротив, акт соединения, вопрос о сложностиМ. был решен отрицательно. М. были отнесены к простым телам, в силуосновной идеи Лавуазье, что простые тела суть те, из которых не удалосьвыделить других тел. Этого взгляда химия держится поныне.
Wikipedia
Металлы
Мета́ллы (лат. metallum от др.-греч. metallon — шахта, рудник) — группа химических элементов, обладающих в виде простых веществ при нормальных условиях характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность, ковкость и характерный металлический блеск.
Esempi dal corpus di testo per Металлы
1. Объект инвестиций традиционен - драгоценные металлы.
2. На другие цветные металлы также отмечалось повышение.
3. НАИБОЛЕЕ ЗАМЕТНО ОБЕСЦЕНИЛИСЬ ЦВЕТНЫЕ МЕТАЛЛЫ И НЕФТЬ.
4. Там находили всевозможные металлы и драгоценные камни.
5. - Цветные металлы вернули полностью, черные - почти все.

![[[Алюминий]] [[Алюминий]]](https://commons.wikimedia.org/wiki/Special:FilePath/Aluminium bar surface etched.jpg?width=200)
![[[Барий]] [[Барий]]](https://commons.wikimedia.org/wiki/Special:FilePath/Barium unter Argon Schutzgas Atmosphäre.jpg?width=200)



![[[Осмий]] [[Осмий]]](https://commons.wikimedia.org/wiki/Special:FilePath/Osmium crystals.jpg?width=200)
