Inserisci una parola o una frase in qualsiasi lingua 👆
Lingua:
Traduzione e analisi delle parole tramite l'intelligenza artificiale ChatGPT
In questa pagina puoi ottenere un'analisi dettagliata di una parola o frase, prodotta utilizzando la migliore tecnologia di intelligenza artificiale fino ad oggi:
- come viene usata la parola
- frequenza di utilizzo
- è usato più spesso nel discorso orale o scritto
- opzioni di traduzione delle parole
- esempi di utilizzo (varie frasi con traduzione)
- etimologia
Cosa (chi) è Рауля законы - definizione
ЗАКОНОМЕРНОСТИ, ОПИСЫВАЮЩИЕ НЕКОТОРЫЕ КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ
Рауля законы; Рауля закон; Закон Рауля
Рауля законы
количественные зависимости, связывающие концентрацию раствора или с давлением насыщенного пара растворителя над раствором, или с изменением температуры кипения (замерзания) раствора. Один из законов Ф. Рауля (См. Рауль) гласит: относительное понижение парциального давления пара растворителя равно мольной доле растворённого вещества, т. е.
где 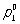 - давление насыщенного пара чистого растворителя при данной температуре, p1 - давление насыщенного пара растворителя над раствором, х2 - мольная доля растворённого вещества. В такой форме закон применим лишь к растворам, насыщенный пар которых ведёт себя как идеальный газ. Растворы, для которых соотношение (1) выполняется при всех концентрациях и при всех температурах в области существования раствора, часто называются идеальными (совершенными). В более общем случае в соотношении (1) должны использоваться не давления и концентрации, а летучести (См. Летучесть) и активности (См. Активность). Для другого закона Рауля, по которому повышение температуры кипения (tкип) или понижение температуры замерзания (tк) раствора прямо пропорционально моляльной концентрации растворённого вещества, имеют место соотношения:
- давление насыщенного пара чистого растворителя при данной температуре, p1 - давление насыщенного пара растворителя над раствором, х2 - мольная доля растворённого вещества. В такой форме закон применим лишь к растворам, насыщенный пар которых ведёт себя как идеальный газ. Растворы, для которых соотношение (1) выполняется при всех концентрациях и при всех температурах в области существования раствора, часто называются идеальными (совершенными). В более общем случае в соотношении (1) должны использоваться не давления и концентрации, а летучести (См. Летучесть) и активности (См. Активность). Для другого закона Рауля, по которому повышение температуры кипения (tкип) или понижение температуры замерзания (tк) раствора прямо пропорционально моляльной концентрации растворённого вещества, имеют место соотношения:
Δtкип = Еэ․m, Δtк = Eкm, (2)
где Δtкип - величина повышения tкип и Δtк - величина понижения tк, m - моляльная концентрация раствора, а Еэ и Ек - т. н. эбулиоскопическая (см. Эбулиоскопия) и криоскопическая (см. Криоскопия) постоянные растворителя (они приводятся во многих физико-химических таблицах). Соотношения (2) используют для определения молекулярной массы (См. Молекулярная масса) растворённого вещества по экспериментально определяемым величинам Δtкип и Δtк.
М. Е. Ерлыкина.
РАУЛЯ ЗАКОН
относительное понижение давления насыщенного пара растворителя над разбавленным раствором равно молярной доле растворенного вещества N:(po - p1)/po = N, где po и p1 - соответствующее давление насыщенного пара чистого растворителя и растворителя над раствором.
Законы Вревского
Вревского законы
Законы Вревского — законы, предложенные Михаилом Степановичем Вревским, описывающие зависимость состава равновесных жидкой и паровой фаз двойных систем от температуры (давления). Основываются на общих термодинамических соотношениях, устанавливающих условия равновесия в двухфазных системах, частным случаем которых является равновесие жидкость — пар.
Wikipedia
Законы Рауля
Зако́ны Рау́ля — общее название открытых французским химиком Ф. М. Раулем в 1887 году количественных закономерностей, описывающих некоторые коллигативные (зависящие от концентрации, но не от природы растворённого вещества) свойства растворов.
