координационные соединения, химические соединения, состав которых не укладывается в рамки представлений об образовании химических связей за счет неспаренных электронов. Обычно более сложные К. с. образуются при взаимодействии простых химических соединений. Так, при взаимодействии цианистых солей железа и калия образуется К. с. - ферроцианид калия: Fe (CN)2 + 4KCN = K4[Fe (CN)6]. К. с. широко распространены. Общее число уже синтезированных комплексных соединений, по-видимому, превышает число соединений, обычно относимых к простым. К. с. существуют в растворах, расплавах, в кристаллическом и газообразном состоянии. Переход вещества из одного физ. состояния в другое может приводить к изменению состава и строения К. с., к распаду одних комплексных группировок и образованию новых.
Ядро К. с. (комплекс) составляет центральный атом - комплексообразователь (в приведённом примере Fe) и координированные, т. е. связанные с ним, молекулы или ионы, называемые лигандами (в данном случае кислотный остаток CN). Лиганды составляют внутреннюю сферу комплекса. Бывают К. с., состоящие только из центрального атома и лигандов, например
Карбонилы металлов Ti (CO)
7, Cr (CO)
6, Fe (CO)
5 и др. Если в состав комплекса входят ионы, не связанные непосредственно с центральным атомом, то их выделяют во внешнюю сферу комплекса. Внешнесферными могут быть и катионы, например К
+ в K
4[Fe (CN)
6], и анионы, например SO
42- в [Сu (MH
3)
4] SO
4. При записи формулы К. с. внешнесферные ионы выносятся за квадратные скобки. Комплексная группировка, несущая избыточный положительный электрический заряд, как в [Cu (NH
3)
4]
2+, или отрицательный, как в [Fe (CN)
6]
4-, называется комплексным ионом. В растворах К. с. с внешнесферными ионами практически нацело диссоциированы по схеме, например:
K2[CoCl4] = 2K++[CoCl4]2-
[Cu (NH3)4] SO4 = [Cu (NH3)4]2++SO42-.
Комплексные ионы тоже могут диссоциировать в растворе. Например:
[CoCl4]2- ⇔ Co2++4Cl-.
Устойчивость К. с. в растворе определяется константой диссоциации К его комплексного иона:
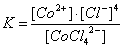
.
(При записи константы диссоциации в квадратные скобки берут равновесные концентрации ионов). Константа диссоциации характеризует термодинамическую устойчивость комплекса, зависящую от энергии связи между центральным атомом и лигандом. Различают также кинетическую устойчивость, или инертность, комплексной группировки - неспособность комплексного иона быстро обменивать внутрисферные ионы или молекулы на другие адденды. Например, [Fe (H2O)6]3+ и [Сr (H2O)6]3+ имеют почти одинаковые энергии связи Me - H2O (116 и 122 ккал/моль), но первый комплекс обменивает лиганды быстро, а второй (инертный) - медленно.
Число ионов или молекул, непосредственно связанных с центральным атомом, называется его координационным числом (К. ч.). Например, в К. с. K4[Fe (CN)6], Ti (CO)7 и [Сu (NH3)4] SO4 К. ч. центральных атомов равны, соответственно, 6, 7 и 4. К. ч. у различных комплексообразователей различны. Их значения меняются в зависимости от размеров и химической природы центральных атомов и лигандов. В настоящее время известны К. ч. от 1 до 12, однако чаще всего приходится иметь дело с К. ч.4 и 6.
Составные части К. с. чрезвычайно разнообразны. В качестве центральных атомов-комплексообразователей чаще всего выступают атомы переходных элементов (Ti, V, Cr, Mn, Fe, Со, Ni, Си, Zn, Zr, Nb, Mo, Fe, Ru, Rh, Pd, Ag, Cd, Hf, Ta, W, Re, Os, lr, Pt, Au, Hg, редкоземельные элементы, элементы группы актиноидов), а также некоторые неметаллы, например В, Р, Si. Лигандами могут быть анионы кислот (F-, Cl-, Br-, I-, CN-, NO-2, SO42-, PO43- и др.) и самые разнообразные нейтральные органические и неорганические молекулы и радикалы, содержащие атомы О, N, Р, S, Se, С.
К. с. с анионами кислот во внутренней сфере (ацидокомплексы) - наиболее типичные представители неорганических комплексов. Самым распространённым лигандом является
Вода. При растворении простых солей в воде образуются аквокомплексы, например, по схеме CoCl
2 + 6H
2O=[Co (H
2O)
6]
2++ 2Cl. Кристаллические аквокомплексы называются кристаллогидратами.
При растворении солей в различных органических и неорганических жидкостях образуются разнообразные сольватокомплексы. Кристаллические сольватокомплексы называют кристаллосольватами. К ним относятся продукты присоединения аммиака -
Аммиакаты, например [Ni (NH
3)
6] Cl
2, продукты присоединения спирта - алкоголяты, эфира - эфираты и т. д. Сложные молекулы присоединяются к центральному атому через атомы кислорода (вода, спирты, эфиры и т. п.), азота (аммиак, его органические производные - амины), фосфора (PCl
3, производные фосфина), углерода и др. Часто лиганд присоединяется к центральному атому несколькими из своих атомов. Такие лиганды называют полидентатными. Среди сложных органических производных встречаются лиганды, координирующиеся двумя, тремя, четырьмя, пятью, шестью и даже восемью атомами (соответственно би-, три-, тетра-, пента-, гекса- и октадентатные лиганды). Полидентатные органические лиганды могут образовать циклические комплексы типа неэлектролитов (см.
Внутрикомплексные соединения)
, например:
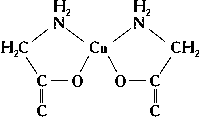
Самыми лучшими лигандами в смысле устойчивости образуемых ими К. с. являются
Комплексоны - аминополикарбоновые кислоты, среди которых наибольшее распространение получила этилендиаминтетрауксусная кислота
(HOOCCH2)2NCH2CH2N (CH2COOH)2 (комплексон II, ЭДТА).
Неорганические ацидолиганды обычно моно-, реже бидентатны. Например, в соединении (NH4)2[Ce (NO3)6] каждая NO3-группа присоединяется к атому церия двумя атомами кислорода и является бидентатной. К. ч. Се в этом соединении равно 12.
Между К. с. и обычными (простыми) соединениями нет определённой границы. Одни и те же вещества, в зависимости от поставленных задач исследования, часто можно рассматривать и как простые и как комплексные. Например, в любом кристаллическом неорганическом веществе атомы, обычно относимые к комплексообразователям, обладают определённым К. ч. и, следовательно, ближайшей сферой, принципиально не отличимой от аналогичной группировки в обычном К. с.
Теория строения К. с. берёт своё начало от представлений А.
Вернера (1893), который ввел важные для целого исторического периода понятия "главной" и "побочной" валентности, а также представления о координации, координационном числе, геометрии комплексной молекулы. Значительный вклад в исследование химии К. с., и, в частности, в установление связи между строением К. с. и реакционной способностью координированных групп, внесли советские учёные Л. А.
Чугаев, И. И.
Черняев и др.
Однако классическая координационная теория оказалась бессильной объяснить причины образования К. с. некоторых новых классов, предсказать их строение, а также установить взаимосвязь между строением и физическими свойствами К. с.
К. с. находят широкое применение для выделения и очистки платиновых металлов, золота, серебра, никеля, кобальта, меди, в процессах разделения редкоземельных элементов, щелочных металлов и в ряде других технологических процессов. К. с. широко используют в химическом анализе для качественного обнаружения и количественного определения самых разнообразных элементов. В живых организмах различные типы К. с. представлены соединениями ионов металлов (Fe, Cu, Mg, Mn, Mo, Zn, Со) с белками (т. н.
Металлопротеиды)
, а также витаминами, коферментами, транспортными и др. веществами, выполняющими специфические функции в обмене веществ. Особенно велика роль природных К. с. в процессах дыхания,
Фотосинтеза
, окисления биологического (См.
Окисление биологическое)
, в ферментативном катализе (См.
Ферментативный катализ)
.
Лит.: Современная химия координационных соединений, под ред. Дж. Льюиса и Р. Уилкинса, пер. с англ., М., 1963; Берсукер И. Б., Аблов А. В., Химическая связь в комплексных соединениях, Кишинев, 1962; Гринберг А. А., Введение в химию комплексных соединений, 2 изд., Л. - М., 1951; Дей К., Селбин Д., Теоретическая неорганическая химия, пер. с англ., М., 1971; Головня В. А., Федоров И. А., Основные понятия химии комплексных соединений, М., 1961; Яцимирский К. Б., Термохимия комплексных соединений, М., 1951; Коттон Ф., Уилкинсон Дж., Современная неорганическая химия, пер. с англ., ч. 1-3, М., 1969.
Б. Ф. Джуринский.


![[[Альфред Вернер]] [[Альфред Вернер]]](https://commons.wikimedia.org/wiki/Special:FilePath/Alfred Werner.jpg?width=200)
![комплексного иона]], образованного катионом металла и анионом [[ЭДТА]] комплексного иона]], образованного катионом металла и анионом [[ЭДТА]]](https://commons.wikimedia.org/wiki/Special:FilePath/Medta.png?width=200)
![''цис''-[CoCl2(NH3)4]+ ''цис''-[CoCl2(NH3)4]+](https://commons.wikimedia.org/wiki/Special:FilePath/Cis-dichlorotetraamminecobalt(III).png?width=200)
![''транс''-[CoCl2(NH3)4]+ ''транс''-[CoCl2(NH3)4]+](https://commons.wikimedia.org/wiki/Special:FilePath/Trans-dichlorotetraamminecobalt(III).png?width=200)
![''Гран- (fac-) граневой''-[CoCl3(NH3)3] ''Гран- (fac-) граневой''-[CoCl3(NH3)3]](https://commons.wikimedia.org/wiki/Special:FilePath/Fac-trichlorotriamminecobalt(III).png?width=200)
![''Ос- (mer-) реберный''-[CoCl3(NH3)3] ''Ос- (mer-) реберный''-[CoCl3(NH3)3]](https://commons.wikimedia.org/wiki/Special:FilePath/Mer-trichlorotriamminecobalt(III).png?width=200)
![Λ-[Fe(ox)3]3− Λ-[Fe(ox)3]3−](https://commons.wikimedia.org/wiki/Special:FilePath/Delta-tris(oxalato)ferrate(III)-3D-balls.png?width=200)
![Δ-[Fe(ox)3]3− Δ-[Fe(ox)3]3−](https://commons.wikimedia.org/wiki/Special:FilePath/Lambda-tris(oxalato)ferrate(III)-3D-balls.png?width=200)
![Λ-''цис''-[CoCl2(en)2]+ Λ-''цис''-[CoCl2(en)2]+](https://commons.wikimedia.org/wiki/Special:FilePath/Delta-cis-dichlorobis(ethylenediamine)cobalt(III).png?width=200)
![Δ-''цис''-[CoCl2(en)2]+ Δ-''цис''-[CoCl2(en)2]+](https://commons.wikimedia.org/wiki/Special:FilePath/Lambda-cis-dichlorobis(ethylenediamine)cobalt(III).png?width=200)
