(μ
i)
термодинамическая функция, применяемая при описании состояния систем с переменным числом частиц. В случае системы, состоящей из
i компонентов, Х. п. определяется как приращение внутренней энергии (См.
Внутренняя энергия)
U системы при добавлении к системе бесконечно малого количества молей
i-того компонента, отнесённое к этому количеству вещества, при постоянных объёме
V, энтропии
S и количествах молей каждого из остальных компонентов
nj (
j ≠
i). В общем случае Х. п. может быть определён как приращение любого из остальных потенциалов термодинамических (См.
Потенциалы термодинамические) системы при различных постоянных параметрах: гиббсовой энергии (См.
Гиббсова энергия)
G - при постоянных давлении
р, температуре
Т и
nj; гельмгольцевой энергии (См.
Гельмгольцева энергия)
А - при постоянных
V,
Т и
nj; энтальпии (См.
Энтальпия)
Н - при постоянных
S,
р и
nj. Таким образом:
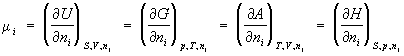
(1)
Х. и. зависит как от концентрации данного компонента, так и от вида и концентрации др. компонентов системы (фазы). Только в простейшем случае - смеси идеальных газов - μi зависит лишь от концентрации рассматриваемого компонента и от температуры:
μi = μi 0+ RT In pi,
где
pi -
Парциальное давление компонента
i в смеси,
R -
Газовая постоянная, μ
i0 - значение μ
i при
pi = 1
атм. Для смеси неидеальных газов в равенстве (2) должна стоять
Фугитивность этого компонента. Х. п. характеризует способность рассматриваемого компонента к выходу из данной фазы (путём испарения, растворения, кристаллизации, химического взаимодействия и т.д.). В многофазных (гетерогенных) системах переход данного компонента может происходить самопроизвольно только из фазы, в которой его Х. п. больше, в фазу, для которой его Х. п. меньше. Такой переход сопровождается уменьшением Х. п. этого компонента в 1-й фазе и увеличением во 2-й. В результате разность между Х. п. данного компонента в этих двух фазах уменьшается и при достижении равновесия Х. п. компонента становится одинаковым в обеих фазах. В любой равновесной гетерогенной системе Х. п. каждого компонента одинаков во всех фазах.
Если в различных фазах или в разных местах одной фазы Х. п. какого-либо компонента неодинаков, то в системе самопроизвольно (без затраты энергии извне) происходит перераспределение частиц, сопровождающееся выравниванием Х. п.
Из условий термодинамического равновесия систем, в которых возможны химические реакции, фазовые переходы и др. процессы перераспределения частиц, и уравнения, учитывающего баланс частиц, вытекают важнейшие термодинамические соотношения:
Действующих масс закон,
Фаз правило Дж. У.
Гиббса, основные законы разбавленных растворов (см.
Вант-Гоффа закон,
Рауля законы,
Генри закон и др.) и т.д.
Х. п. в качестве нормировочной постоянной входит в распределение Больцмана, а также в распределения по энергиям Бозе - Эйнштейна и Ферми - Дирака для частиц идеального газа (см.
Статистическая физика). Х. п. вырожденного газа электронов (
Ферми-газа) тождественно совпадает с граничной ферми энергией (См.
Ферми энергия).
Х. п. был введён Гиббсом, численно выражается в единицах энергии на единицу количества вещества (дж/моль) или на единицу массы (дж/кг).
И. А. Кузнецов.
