Введите слово или словосочетание на любом языке 👆
Язык:
Перевод и анализ слов искусственным интеллектом ChatGPT
На этой странице Вы можете получить подробный анализ слова или словосочетания, произведенный с помощью лучшей на сегодняшний день технологии искусственного интеллекта:
- как употребляется слово
- частота употребления
- используется оно чаще в устной или письменной речи
- варианты перевода слова
- примеры употребления (несколько фраз с переводом)
- этимология
Что (кто) такое АЗОТ - К ВОДОРОДНЫЕ СОЕДИНЕНИЯ АЗОТА - определение
ХИМИЧЕСКОЕ СОЕДИНЕНИЕ
Трехфтористый азот; Трёхфтористый азот; Трифторид азота; Фторид азота (III)
Найдено результатов: 1245
АЗОТ - К. ВОДОРОДНЫЕ СОЕДИНЕНИЯ АЗОТА
К статье АЗОТ
Азот и водород взаимодействуют, образуя соединения, отдаленно напоминающие углеводороды (см. также ОРГАНИЧЕСКАЯ ХИМИЯ). Стабильность азотоводородов уменьшается с увеличением числа атомов азота в цепи в отличие от углеводородов, которые устойчивы и в длинных цепях. Наиболее важные нитриды водорода - аммиак NH3 и гидразин N2H4. К ним относится также азотистоводородная кислота HNNN (HN3).
Жидкий азот
АГРЕГАТНОЕ СОСТОЯНИЕ АЗОТА
Азот жидкий
Жидкий азот — прозрачная жидкость. Является одним из четырёх агрегатных состояний азота. Жидкий азот обладает удельной плотностью 0,808 г/см³ и имеет точку кипения 77,4 K (−195,75 °C). Не взрывоопасен и не ядовит. Впервые получен Раулем Пикте.
Новомосковский химический комбинат
РОССИЙСКОЕ ХИМИЧЕСКОЕ ПРЕДПРИЯТИЕ
НПО «Азот»; НАК «Азот»; Новомосковская акционерная компания Азот; НАК «АЗОТ»; Бобриковский химкомбинат; Новомосковский химкомбинат; Сталиногорский химкомбинат; Новомосковская акционерная компания «Азот»; Сталиногорский химический комбинат; ОАО НАК «Азот»; АК «Азот»; Новомосковский химический комбинат; Бобриковский химический комбинат
им. Владимира Ильича Ленина, крупное предприятие химической промышленности, специализирующееся на выпуске аммиака, хлора и продуктов их переработки, продукции органического синтеза и др. химических продуктов. Расположен в Новомосковске Тульской области. Первая очередь введена в строй в конце 1933. В годы Великой Отечественной войны 1941-45 комбинат был разрушен. Довоенный уровень производства был достигнут к 1950. В последующие годы, особенно после решения Майского (1958) пленума ЦК КПСС о развитии химической промышленности, на предприятии была проведена реконструкция и значительно расширено производство. В 1958 впервые в СССР здесь из природного газа был получен аммиак и налажено производство азотных удобрений. Производство продукции на комбинате возросло по сравнению с 1934 в 1940 в 3,8 раза, в 1950 - в 4,1, в 1960 - в 11,5, в 1970 - в 56,6 раза. Награжден орденом Трудового Красного Знамени (1959).
Лит.: Новомосковский химический комбинат. (Исторический очерк), Тула, 1965.
Н. П. Сумцов.
Фториды азота
СТРАНИЦА ЗНАЧЕНИЙ В ПРОЕКТЕ ВИКИМЕДИА
Азота фториды
неорганические соединения, содержащие связь N-F, например трифторид азота NF3, тетрафторгидразин N2F4, дифторамин NF2H, фтористый нитрозил FNO и др. Ф. а. - бесцветные газы со специфическим запахом. При нагревании разлагаются на элементы или трифторид азота и азот (за исключением NF3 и FNO). Проявляют свойства сильных окислителей. С органическими соединениями некоторые Ф. а. образуют многочисленные органические вещества, содержащие группы -NF2 и -NONF. Особенность Ф. а. состоит в том, что при взаимодействии с сильными льюисовскими кислотами (см. Кислоты и основания) они образуют соли с фторазотными катионами 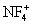 ,
, 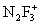 ,
, 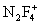 , F2NO+.
, F2NO+.
Трифторид азота, NF3 - газ; tпл - 208,5°С, tkип - 129,1°С. Окислительная способность проявляется при высоких температурах. Превращается в тетрафторгидразин при повышенных температурах и в присутствии меди, железа, ртути или угля. Получается электролизом расплава дифторида аммония или фторированием азотсодержащих веществ. Применяется в производстве тетрафторгидразина.
Тетрафторгидразин, N2F4 - газ; tпл - 161,5°С, tkип - 74,2°С. Способен к диссоциации: N2F4 ⇔ 2NF2. При 150°С и давлении 0,1 Мн/м2 (1 кгс/см2) степень диссоциации 0,2. Диссоциация N2F4 обусловливает его дифтораминирующее действие, которое проявляется, например, в присоединении к олефинам:
. Тетрафторгидразин получается конверсией трифторида азота над углём (промышленный метод), разложением NF2H или окислением его растворов. Применяется для синтеза органических дифтораминосоединений.
Дифторамин, NF2H - газ; tпл - 116°С, tkип - 23°С. Взрывается при ударе (особенно в жидком и твёрдом состояниях). Проявляет амфотерные свойства. В реакциях действует как дифтораминирующий агент. Получается действием серной кислоты на дифтораминомочевину (продукт фторирования мочевины) или на трифенилметил дифторамин, синтезируемый из N2F4 и трифенилметилхлорида в присутствии ртути. Применяется для синтеза органических дифтораминосоединений.
Лит.: Панкратов А. В., Химия фторидов азота, М., 1973.
А. В. Панкратов.
Сераорганические соединения
Серосодержащие соединения; Серусодержащие соединения; Тиосоединения; Тиоорганические соединения; Серосодержащие органические соединения; Сероорганические соединения; Тио; Тио-
Сераоргани́ческие соедине́ния — обширный класс химических соединений, содержащих в молекуле связь углерод — сера.
Фториды азота
СТРАНИЦА ЗНАЧЕНИЙ В ПРОЕКТЕ ВИКИМЕДИА
Азота фториды
Фториды азота — неорганические соединения азота со фтором. Известны трифторид азота NF, Дифтордиазин NF, тетрафторгидразин NF, азид фтора FN, а также оксифторид азота NOF.
АЗОТ
ХИМИЧЕСКИЙ ЭЛЕМЕНТ С ПОРЯДКОВЫМ НОМЕРОМ 7
E941; Открытие азота; Е941; Nitrogen; Нитроген; Nitrogenium; Азот-15
N (nitrogenium), химический элемент (ат. номер 7) VA подгруппы периодической системы элементов. Атмосфера Земли содержит 78% (об.) азота. Чтобы показать, как велики эти запасы азота, отметим, что в атмосфере над каждым квадратным километром земной поверхности находится столько азота, что из него можно получить до 50 млн. т нитрата натрия или 10 млн. т аммиака (соединение азота с водородом) и все же это составляет малую долю азота, содержащегося в земной коре. Существование свободного азота свидетельствует о его инертности и трудности взаимодействия с другими элементами при обычной температуре. Связанный азот входит в состав как органической, так и неорганической материи. Растительный и животный мир содержит азот, связанный с углеродом и кислородом в белках. Помимо этого известны и могут быть получены в больших количествах азотсодержащие неорганические соединения, такие, как нитраты (NO3-), нитриты (NO2-), цианиды (CN-), нитриды (N3-) и азиды (N3-).
См. также:
Сераорганические соединения
Серосодержащие соединения; Серусодержащие соединения; Тиосоединения; Тиоорганические соединения; Серосодержащие органические соединения; Сероорганические соединения; Тио; Тио-
вещества, содержащие в молекуле связь углерод - сера. С. с. многочисленны и разнообразны; сера, наряду с водородом, кислородом, азотом и галогенами, - один из основных элементов-органогенов. В С. с. атом S может находиться в любой характерной для него степени окисления: S (-2), S (+4) и S (+6). Главные типы С. с. (R, R', Ar - органический остаток): 1) содержащие S (-2) - Меркаптаны (тиоспирты) RSH, Тиофенолы ArSH, тиоальдегиды R - CH=S и тиокетоны R - CS - R', Тиокислоты 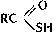 (тиоловые кислоты),
(тиоловые кислоты),  (тионовые кислоты) и
(тионовые кислоты) и 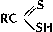 (дитиокислоты), а также их разнообразные производные, тиоэфиры (органические Сульфиды) R - S - R', ди- и полисульфиды R - Sx - R' (x ≥ 2), соли сульфония RR'S+X - (X - анион, например Cl -; см. Ониевые соединения), серосодержащие гетероциклы, например Тиофен, а также многочисленные соединения различных классов, несущие серосодержащую группировку, например меркаптоаминокислоты; 2) С. с., содержащие S (+4), - сульфиновые кислоты
(дитиокислоты), а также их разнообразные производные, тиоэфиры (органические Сульфиды) R - S - R', ди- и полисульфиды R - Sx - R' (x ≥ 2), соли сульфония RR'S+X - (X - анион, например Cl -; см. Ониевые соединения), серосодержащие гетероциклы, например Тиофен, а также многочисленные соединения различных классов, несущие серосодержащую группировку, например меркаптоаминокислоты; 2) С. с., содержащие S (+4), - сульфиновые кислоты 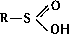 и сульфоксиды RSOR'; 3) содержащие S (+6), - сульфокислоты RSO3H и сульфоны R - SO2 - R'.
и сульфоксиды RSOR'; 3) содержащие S (+6), - сульфокислоты RSO3H и сульфоны R - SO2 - R'.
Основные методы синтеза С. с. основаны на реакциях органических соединений с элементарной серой или её простейшими неорганическими соединениями:
H2S, Na2S, NaSH, SCI2, SO2, SO3, H2SO4.
Ниже приведены схемы некоторых реакций:
Ar - H + H2SO4 → ArSO3H + H2O
Большое значение имеют также методы, основанные на взаимных превращениях С. с.
К С. с. принадлежат многие важные природные вещества, например аминокислоты Цистеин и Метионин, ряд коферментов (См. Коферменты) (кофермент А, липоевая кислота), витаминов (тиамин, биотин), антибиотиков (например, Пенициллины). Сульфгидрильные группы цистеина играют важную роль в активном центре многих ферментов. Дисульфидные связи цистина, образующиеся в результате связывания двух остатков цистеина, участвуют в поддержании пространственной структуры белков (См. Белки) и пептидов. К С. с. относятся также многочисленные лекарственные и физиологически активные синтетические вещества, в том числе Сульфаниламидные препараты, Радиозащитные средства (цистамин, цистафос и др.), инсектофунгициды и ростовые вещества, отравляющие вещества (иприт), Красители различных классов - сернистые, некоторые анилиновые, антрахиноновые, фталоцианиновые. Как С. с. можно рассматривать и некоторые высокомолекулярные соединения, например Полисульфидные каучуки (тиоколы); на образовании С. с. основана Вулканизация каучуков серой (и сё производными). С. с. используются в качестве ингибиторов полимеризации и окисления, стабилизаторов полимерных материалов (меркаптобензимидазол и др.), растворителей (тетраметиленсульфон, диметилсульфоксид). Соли органических сульфокислот применяют как поверхностно-активные вещества (Моющие средства). Многие С. с., например ароматические сульфокислоты, - важные полупродукты основного органического синтеза.
Б. Л. Дяткин.
азот
ХИМИЧЕСКИЙ ЭЛЕМЕНТ С ПОРЯДКОВЫМ НОМЕРОМ 7
E941; Открытие азота; Е941; Nitrogen; Нитроген; Nitrogenium; Азот-15
| Химический элемент (·хим. ).
АЗОТ
ХИМИЧЕСКИЙ ЭЛЕМЕНТ С ПОРЯДКОВЫМ НОМЕРОМ 7
E941; Открытие азота; Е941; Nitrogen; Нитроген; Nitrogenium; Азот-15
а, мн. нет, м.
Химический элемент, газ без цвета и запаха, главная составная часть воздуха и один из основных элементов питания растений. Азотный - относящийся к азоту. Азотистый - включающий в свой состав а. Азотизация, азотирование (тех.) - насыщение поверхности стального изделия азотом с целью придания ему большей твердости, износоустойчивости и коррозийной стойкости. | А. не поддерживает дыхания и горения, - отсюда название.
Википедия
Фторид азота(III)

Трифтори́д азо́та (фторид азота(III), трёхфтористый азот) — бинарное неорганическое соединение азота и фтора с формулой , бесцветный ядовитый тяжёлый газ, негорюч, вызывает коррозию металлов, имеет характерный затхлый запах плесени, плохо растворяется в воде.
Вызывает сильный парниковый эффект.
Применяется в качестве травителя в микроэлектронике.






![Оптический [[эмиссионный спектр]] азота Оптический [[эмиссионный спектр]] азота](https://commons.wikimedia.org/wiki/Special:FilePath/Nitrogen.Spectrum.Vis.jpg?width=200)

