Введите слово или словосочетание на любом языке 👆
Язык:
Перевод и анализ слов искусственным интеллектом ChatGPT
На этой странице Вы можете получить подробный анализ слова или словосочетания, произведенный с помощью лучшей на сегодняшний день технологии искусственного интеллекта:
- как употребляется слово
- частота употребления
- используется оно чаще в устной или письменной речи
- варианты перевода слова
- примеры употребления (несколько фраз с переводом)
- этимология
Что (кто) такое АЗОТ - Т ОКСИДЫ АЗОТА - определение
ХИМИЧЕСКОЕ СОЕДИНЕНИЕ
Трехфтористый азот; Трёхфтористый азот; Трифторид азота; Фторид азота (III)
Найдено результатов: 394
Жидкий азот
АГРЕГАТНОЕ СОСТОЯНИЕ АЗОТА
Азот жидкий
Жидкий азот — прозрачная жидкость. Является одним из четырёх агрегатных состояний азота. Жидкий азот обладает удельной плотностью 0,808 г/см³ и имеет точку кипения 77,4 K (−195,75 °C). Не взрывоопасен и не ядовит. Впервые получен Раулем Пикте.
АЗОТ - Т. ОКСИДЫ АЗОТА
К статье АЗОТ
В соединениях с кислородом азот проявляет все степени окисления, образуя оксиды: N2O, NO, N2O3, NO2 (N2O4), N2O5. Имеется скудная информация об образовании пероксидов азота (NO3, NO4).
Оксид азота(I) N2O (монооксид диазота) получается при термической диссоциации нитрата аммония:
Молекула имеет линейное строение
N2O довольно инертен при комнатной температуре, но при высоких температурах может поддерживать горение легко окисляющихся материалов. N2O, известный как "веселящий газ", используют для умеренной анестезии в медицине.
Оксид азота(II) NO - бесцветный газ, является одним из продуктов каталитической термической диссоциации аммиака в присутствии кислорода:
NO образуется также при термическом разложении азотной кислоты или при реакции меди с разбавленной азотной кислотой:
NO можно получать синтезом из простых веществ (N2 и O2) при очень высоких температурах, например, в электрическом разряде. В структуре молекулы NO имеется один неспаренный электрон. Соединения с такой структурой взаимодействуют с электрическим и магнитным полями. В жидком или твердом состоянии оксид имеет голубую окраску, поскольку неспаренный электрон вызывает частичную ассоциацию в жидком состоянии и слабую димеризацию в твердом состоянии: 2NO N2O2.
Оксид азота(III) N2O3 (триоксид азота) - ангидрид азотистой кислоты: N2O3 + H2O 2HNO2. Чистый N2O3 может быть получен в виде голубой жидкости при низких температурах (-20. С) из эквимолекулярной смеси NO и NO2. N2O3 устойчив только в твердом состоянии при низких температурах (т.пл. -102,3. С), в жидком и газообразном состояния он снова разлагается на NO и NO2.
Оксид азота(IV) NO2 (диоксид азота) также имеет в молекуле неспаренный электрон (см. выше оксид азота(II)). В строении молекулы предполагается трехэлектронная связь, и молекула проявляет свойства свободного радикала (одна линия соответствует двум спаренным электронам):
NO2 получается каталитическим окислением аммиака в избытке кислорода или окислением NO на воздухе:
а также по реакциям:
При комнатной температуре NO2 - газ темнокоричневого цвета, обладает магнитными свойствами благодаря наличию неспаренного электрона. При температурах ниже 0. C молекула NO2 димеризуется в тетраоксид диазота, причем при -9,3. C димеризация протекает полностью: 2NO2 N2O4. В жидком состоянии недимеризовано только 1% NO2, а при 100. C остается в виде димера 10% N2O4.
NO2 (или N2O4) реагирует в теплой воде с образованием азотной кислоты: 3NO2 + H2O = 2HNO3 + NO. Технология NO2 поэтому очень существенна как промежуточная стадия получения промышленно важного продукта - азотной кислоты.
Оксид азота(V) N2O5 (устар. ангидрид азотной кислоты) - белое кристаллическое вещество, получается обезвоживанием азотной кислоты в присутствии оксида фосфора P4O10:
N2O5 легко растворяется во влаге воздуха, вновь образуя HNO3. Свойства N2O5 определяются равновесием
N2O5 - хороший окислитель, легко реагирует, иногда бурно, с металлами и органическими соединениями и в чистом состоянии при нагреве взрывается. Вероятную структуру N2O5 можно представить как
Новомосковский химический комбинат
РОССИЙСКОЕ ХИМИЧЕСКОЕ ПРЕДПРИЯТИЕ
НПО «Азот»; НАК «Азот»; Новомосковская акционерная компания Азот; НАК «АЗОТ»; Бобриковский химкомбинат; Новомосковский химкомбинат; Сталиногорский химкомбинат; Новомосковская акционерная компания «Азот»; Сталиногорский химический комбинат; ОАО НАК «Азот»; АК «Азот»; Новомосковский химический комбинат; Бобриковский химический комбинат
им. Владимира Ильича Ленина, крупное предприятие химической промышленности, специализирующееся на выпуске аммиака, хлора и продуктов их переработки, продукции органического синтеза и др. химических продуктов. Расположен в Новомосковске Тульской области. Первая очередь введена в строй в конце 1933. В годы Великой Отечественной войны 1941-45 комбинат был разрушен. Довоенный уровень производства был достигнут к 1950. В последующие годы, особенно после решения Майского (1958) пленума ЦК КПСС о развитии химической промышленности, на предприятии была проведена реконструкция и значительно расширено производство. В 1958 впервые в СССР здесь из природного газа был получен аммиак и налажено производство азотных удобрений. Производство продукции на комбинате возросло по сравнению с 1934 в 1940 в 3,8 раза, в 1950 - в 4,1, в 1960 - в 11,5, в 1970 - в 56,6 раза. Награжден орденом Трудового Красного Знамени (1959).
Лит.: Новомосковский химический комбинат. (Исторический очерк), Тула, 1965.
Н. П. Сумцов.
Фториды азота
СТРАНИЦА ЗНАЧЕНИЙ В ПРОЕКТЕ ВИКИМЕДИА
Азота фториды
неорганические соединения, содержащие связь N-F, например трифторид азота NF3, тетрафторгидразин N2F4, дифторамин NF2H, фтористый нитрозил FNO и др. Ф. а. - бесцветные газы со специфическим запахом. При нагревании разлагаются на элементы или трифторид азота и азот (за исключением NF3 и FNO). Проявляют свойства сильных окислителей. С органическими соединениями некоторые Ф. а. образуют многочисленные органические вещества, содержащие группы -NF2 и -NONF. Особенность Ф. а. состоит в том, что при взаимодействии с сильными льюисовскими кислотами (см. Кислоты и основания) они образуют соли с фторазотными катионами 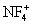 ,
, 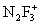 ,
, 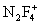 , F2NO+.
, F2NO+.
Трифторид азота, NF3 - газ; tпл - 208,5°С, tkип - 129,1°С. Окислительная способность проявляется при высоких температурах. Превращается в тетрафторгидразин при повышенных температурах и в присутствии меди, железа, ртути или угля. Получается электролизом расплава дифторида аммония или фторированием азотсодержащих веществ. Применяется в производстве тетрафторгидразина.
Тетрафторгидразин, N2F4 - газ; tпл - 161,5°С, tkип - 74,2°С. Способен к диссоциации: N2F4 ⇔ 2NF2. При 150°С и давлении 0,1 Мн/м2 (1 кгс/см2) степень диссоциации 0,2. Диссоциация N2F4 обусловливает его дифтораминирующее действие, которое проявляется, например, в присоединении к олефинам:
. Тетрафторгидразин получается конверсией трифторида азота над углём (промышленный метод), разложением NF2H или окислением его растворов. Применяется для синтеза органических дифтораминосоединений.
Дифторамин, NF2H - газ; tпл - 116°С, tkип - 23°С. Взрывается при ударе (особенно в жидком и твёрдом состояниях). Проявляет амфотерные свойства. В реакциях действует как дифтораминирующий агент. Получается действием серной кислоты на дифтораминомочевину (продукт фторирования мочевины) или на трифенилметил дифторамин, синтезируемый из N2F4 и трифенилметилхлорида в присутствии ртути. Применяется для синтеза органических дифтораминосоединений.
Лит.: Панкратов А. В., Химия фторидов азота, М., 1973.
А. В. Панкратов.
Фториды азота
СТРАНИЦА ЗНАЧЕНИЙ В ПРОЕКТЕ ВИКИМЕДИА
Азота фториды
Фториды азота — неорганические соединения азота со фтором. Известны трифторид азота NF, Дифтордиазин NF, тетрафторгидразин NF, азид фтора FN, а также оксифторид азота NOF.
АЗОТ
ХИМИЧЕСКИЙ ЭЛЕМЕНТ С ПОРЯДКОВЫМ НОМЕРОМ 7
E941; Открытие азота; Е941; Nitrogen; Нитроген; Nitrogenium; Азот-15
N (nitrogenium), химический элемент (ат. номер 7) VA подгруппы периодической системы элементов. Атмосфера Земли содержит 78% (об.) азота. Чтобы показать, как велики эти запасы азота, отметим, что в атмосфере над каждым квадратным километром земной поверхности находится столько азота, что из него можно получить до 50 млн. т нитрата натрия или 10 млн. т аммиака (соединение азота с водородом) и все же это составляет малую долю азота, содержащегося в земной коре. Существование свободного азота свидетельствует о его инертности и трудности взаимодействия с другими элементами при обычной температуре. Связанный азот входит в состав как органической, так и неорганической материи. Растительный и животный мир содержит азот, связанный с углеродом и кислородом в белках. Помимо этого известны и могут быть получены в больших количествах азотсодержащие неорганические соединения, такие, как нитраты (NO3-), нитриты (NO2-), цианиды (CN-), нитриды (N3-) и азиды (N3-).
См. также:
азот
ХИМИЧЕСКИЙ ЭЛЕМЕНТ С ПОРЯДКОВЫМ НОМЕРОМ 7
E941; Открытие азота; Е941; Nitrogen; Нитроген; Nitrogenium; Азот-15
| Химический элемент (·хим. ).
АЗОТ
ХИМИЧЕСКИЙ ЭЛЕМЕНТ С ПОРЯДКОВЫМ НОМЕРОМ 7
E941; Открытие азота; Е941; Nitrogen; Нитроген; Nitrogenium; Азот-15
а, мн. нет, м.
Химический элемент, газ без цвета и запаха, главная составная часть воздуха и один из основных элементов питания растений. Азотный - относящийся к азоту. Азотистый - включающий в свой состав а. Азотизация, азотирование (тех.) - насыщение поверхности стального изделия азотом с целью придания ему большей твердости, износоустойчивости и коррозийной стойкости. | А. не поддерживает дыхания и горения, - отсюда название.
АЗОТ
ХИМИЧЕСКИЙ ЭЛЕМЕНТ С ПОРЯДКОВЫМ НОМЕРОМ 7
E941; Открытие азота; Е941; Nitrogen; Нитроген; Nitrogenium; Азот-15
(лат. Nitrogenium), N, химический элемент V группы периодической системы, атомный номер 7, атомная масса 14,0067. Название от греческой a - отрицательная приставка и zoe - жизнь (не поддерживает дыхания и горения). Свободный азот состоит из 2-атомных молекул (N2); газ без цвета и запаха; плотность 1,25 г/л, tпл - 210 °C, tкип - 195,8 °C. Химически весьма инертен, однако реагирует с комплексными соединениями переходных металлов. Основной компонент воздуха (78,09% объема), разделением которого получают промышленный азот (более 3/4 идет на синтез аммиака). Применяется как инертная среда для многих технологических процессов; жидкий азот - хладагентный азот - один из основных биогенных элементов, входящий в состав белков и нуклеиновых кислот.
твердо
БУКВА КИРИЛЛИЦЫ
Твердо; Т (буква); Буква Т; Т (former Unicode lowercase); ᲅ; Ⱅ; T (кириллица)
II. ТВЁРДО. нареч. к твердый
во всех ·знач., кроме 1 и 2.
во всех ·знач., кроме 1 и 2.
Википедия
Фторид азота(III)

Трифтори́д азо́та (фторид азота(III), трёхфтористый азот) — бинарное неорганическое соединение азота и фтора с формулой , бесцветный ядовитый тяжёлый газ, негорюч, вызывает коррозию металлов, имеет характерный затхлый запах плесени, плохо растворяется в воде.
Вызывает сильный парниковый эффект.
Применяется в качестве травителя в микроэлектронике.






![Оптический [[эмиссионный спектр]] азота Оптический [[эмиссионный спектр]] азота](https://commons.wikimedia.org/wiki/Special:FilePath/Nitrogen.Spectrum.Vis.jpg?width=200)



