Введите слово или словосочетание на любом языке 👆
Язык:
Перевод и анализ слов искусственным интеллектом ChatGPT
На этой странице Вы можете получить подробный анализ слова или словосочетания, произведенный с помощью лучшей на сегодняшний день технологии искусственного интеллекта:
- как употребляется слово
- частота употребления
- используется оно чаще в устной или письменной речи
- варианты перевода слова
- примеры употребления (несколько фраз с переводом)
- этимология
Что (кто) такое Ваальс - определение
Ваальс, Иоганес Дидерик ван дер; Ван дер Ваальс; Ван-дер-Ваальс; Ван-Дер-Ваальс; Ян Ван-Дер-Ваальс; Ван-Дер-Ваальс, Ян; Ян Дидерик Ван-Дер-Ваальс; Ван-Дер-Ваальс Я.; Ван-Дер-Ваальс Я. Д.; Ван-Дер-Ваальс Ян Дидерик; Ван-Дер-Ваальс, Ян Дидерик; Ван-дер-Ваальс, Йоханнес Дидерик; Ян Ван-дер-Ваальс; Ван-дер-Ваальс, Ян; Ян Дидерик Ван-дер-Ваальс; Ван-дер-Ваальс Ян Дидерик; Ваальс Иоганес Дидерик ван дер; Иоганес Дидерик ван дер Ваальс; Ван-дер-Ваальс Йоханнес Дидерик; Йоханнес Дидерик Ван-дер-Ваальс; Ван-Дер-Ваальс Ян; Йоханнес Ван-дер-Ваальс; Ван-дер-Ваальс Я.; Ван-дер-Ваальс Я. Д.; Ваальс; Ваальс, Йоханнес Дидерик ван дер; Ван-дер-Ваальс, Ян Дидерик; Йоханнес Дидерик Ван дер Ваальс
Найдено результатов: 11
Ваальс
Ван-дер-Ваальс (van der Waals), Валс Ян Дидерик ван дер (23.11.1837, Лейден, - 9.3.1923, Амстердам), голландский физик. Самостоятельно изучил физику. Профессор университета в Амстердаме (1877-1907). В 1873 в работе "О непрерывности газообразного и жидкого состояния" В., приняв во внимание объём молекул и их взаимное притяжение, пришёл к идее о непрерывности газообразного и жидкого состояния вещества и вывел уравнение, носящее его имя (см. Ван-дер-Ваальса уравнение), одинаково применимое к жидкости и газу и дающее результаты, близкие к опытным (за эту работу В. была присвоена степень доктора). Это уравнение (в приведённом виде) привело его к открытию закона соответственных состояний (См. Соответственные состояния). В 1890 В. дал общее уравнение для бинарных двухфазных смесей. В. внёс также существенный вклад в термодинамическую теорию капиллярности. Нобелевская премия (1910).
Соч.: über die Kontinuität des gasförmigen und flüssigen Zustandes, Lpz., 1881; в рус. пер.- Курс термостатики, ч. 1-2, М., 1936 (совм. с ф. Констаммом).

Я. Д. Ваальс.
ВААЛЬС
Й. Д. ван дер, см. Ван-дер-Ваальс Й. Д.
ВАН-ДЕР-ВААЛЬС, ЯН ДИДЕРИК
(Waals, Johannes Diderik van der) (1837-1923), нидерландский физик, удостоенный Нобелевской премии по физике 1910 за вывод уравнений агрегатных состояний газов и жидкостей. Родился 23 ноября 1837 в Лейдене. Самостоятельно изучал физику в Лейденском университете. В 1873 представил докторскую диссертацию О непрерывности газообразного и жидкого состояния. С 1877 по 1907 был профессором физики Амстердамского университета.
Работы Ван-дер-Ваальса посвящены молекулярной физике и изучению низкотемпературных явлений. В 1873 он вывел уравнение состояния реального газа, учитывающее как собственный объем молекул, так и взаимодействие между ними (уравнение Ван-дер-Ваальса). Из этого уравнения следовало, что при определенных давлении, температуре и объеме вещество находится в критическом состоянии. Введя т.н. "приведенные параметры", получил уравнение состояния, не содержащее индивидуальных для каждого вещества констант; из этого уравнения следовал закон соответственных состояний. В 1890 Ван-дер-Ваальс открыл закон бинарных смесей, в 1894 разработал термодинамическую теорию капиллярности. Умер Ван-дер-Ваальс в Амстердаме 9 марта 1923.
ВАН-ДЕР-ВААЛЬС
(van der Waals) Йоханнес Дидерик (1837-1923) , нидерландский физик. Вывел уравнение состояния для реальных газов (уравнение Ван-дер-Ваальса). Нобелевская премия (1910).
Ван-дер-Ваальс
Ян Дидерик, голландский физик; см. Ваальс Я. Д. ван дер.
ВАН-ДЕР-ВААЛЬСА УРАВНЕНИЕ
предложенное Й. Д. Ван-дер-Ваальсом (1873), уравнение состояния реального газа, учитывающее конечность объема молекул и наличие межмолекулярных сил притяжения; для одного моля имеет вид: (p+a/V2)(V-b) V = RT,где: p - давление, V - мольный объем, T - абсолютная температура, R - газовая постоянная, a и b - постоянные, характеризующие взаимодействие молекул данного вещества.
Ван-дер-Ваальса уравнение
одно из первых уравнений состояния реального газа, предложенное голландским физиком Я. Д. Ван-дер-Ваальсом (1873):
Здесь: р - давление газа; Т - его температура; V̅ - объём одного моля вещества; R - универсальная Газовая постоянная; а и b - константы, учитывающие отклонение свойств реального газа от свойств идеального. Член 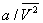 , имеющий размерность давления, учитывает притяжение между молекулами газа за счёт ван-дер-ваальсовых сил (см. Межмолекулярное взаимодействие). Константа b является поправкой на собственный объём молекул газа и учитывает отталкивание молекул на близких расстояниях. Константы а и b обычно определяются из экспериментальных данных. При больших V̅ можно пренебречь обеими поправками и В. у. переходит в уравнение состояния идеального газа (см. Клапейрона уравнение).
, имеющий размерность давления, учитывает притяжение между молекулами газа за счёт ван-дер-ваальсовых сил (см. Межмолекулярное взаимодействие). Константа b является поправкой на собственный объём молекул газа и учитывает отталкивание молекул на близких расстояниях. Константы а и b обычно определяются из экспериментальных данных. При больших V̅ можно пренебречь обеими поправками и В. у. переходит в уравнение состояния идеального газа (см. Клапейрона уравнение).
В. у. является приближённым и количественно описывает свойства реальных газов лишь в области высоких температур и низких давлений. Однако качественно оно позволяет описывать поведение газа при высоких давлениях, конденсацию газа в жидкость и Критическое состояние (см. также Уравнение состояния).
На рис. изображено семейство изотерм (кривых зависимости р от V̅ при постоянной температуре), рассчитанных по В. у. Это уравнение, кубическое относительно V̅, имеет три корня. При низких температурах все три корня - действительные, а выше определённой температуры Тк, называемой критической, остаётся лишь один действительный корень. Физически это означает, что при Т > Тк вещество может находиться лишь в одном (газообразном) состоянии, а ниже Тк - в трёх состояниях (двух стабильных - жидком  и газообразном
и газообразном  - и одном нестабильном). Графически это выражается так: при Т < Тк изотерма имеет три точки пересечения с прямой ac, параллельной оси объёмов. Точки прямой ac отвечают равновесию жидкости и её насыщенного пара. В условиях равновесия, например в состоянии, соответствующем точке b, относительные количества жидкости и пара определяются отношением отрезков bc/ba ("правило моментов"). Равновесию фаз при определённой температуре соответствуют давление насыщенного пара рнп и интервал объёмов от
- и одном нестабильном). Графически это выражается так: при Т < Тк изотерма имеет три точки пересечения с прямой ac, параллельной оси объёмов. Точки прямой ac отвечают равновесию жидкости и её насыщенного пара. В условиях равновесия, например в состоянии, соответствующем точке b, относительные количества жидкости и пара определяются отношением отрезков bc/ba ("правило моментов"). Равновесию фаз при определённой температуре соответствуют давление насыщенного пара рнп и интервал объёмов от  до V̅r. При более низких давлениях (правее V̅r) изотерма характеризует свойства газа. Левая, почти вертикальная часть изотермы отражает очень малую сжимаемость жидкости. Участки ad и ес относятся соответственно к перегретой жидкости и переохлажденному пару (метастабильные состояния (См. Метастабильное состояние)). Участок de физически неосуществим, так как здесь происходит увеличение объёма при увеличении давления. Совокупность точек а, a', а"... и с, c', с"... определяет кривую, называемую бинодалью, которая очерчивает область совместного существования газа и жидкости. В критической точке К температура, давление и объём (Тк, рк,
до V̅r. При более низких давлениях (правее V̅r) изотерма характеризует свойства газа. Левая, почти вертикальная часть изотермы отражает очень малую сжимаемость жидкости. Участки ad и ес относятся соответственно к перегретой жидкости и переохлажденному пару (метастабильные состояния (См. Метастабильное состояние)). Участок de физически неосуществим, так как здесь происходит увеличение объёма при увеличении давления. Совокупность точек а, a', а"... и с, c', с"... определяет кривую, называемую бинодалью, которая очерчивает область совместного существования газа и жидкости. В критической точке К температура, давление и объём (Тк, рк, 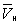 ) имеют значения, характерные для каждого вещества. Однако, если в В. у. ввести относительные величины: Т/Тк, Р/рк и
) имеют значения, характерные для каждого вещества. Однако, если в В. у. ввести относительные величины: Т/Тк, Р/рк и 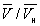 , то можно получить так называемое приведённое В. у., которое является универсальным, то есть не зависит от индивидуальных свойств вещества.
, то можно получить так называемое приведённое В. у., которое является универсальным, то есть не зависит от индивидуальных свойств вещества.
Лит.: Штрауф Е. А., Молекулярная физика, Л. - М., 1949; 3оммерфельд А., Термодинамика и статистическая физика, пер. с нем., М., 1955: Вукалович М. П. и Новиков И. И., Уравнение состояния реальных газов, М. - Л., 1948.
А. А. Лопаткин.
Диаграмма состояния вещества в координатах объем - давление (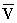 , p): Т1, Т2, Т3, Тк - изотермы, рассчитаные по уравнению Ван-дер-Ваальса; К - критическая точка. Линия dke ("спинодаль") очерчивает область неустойчивых состояний.
, p): Т1, Т2, Т3, Тк - изотермы, рассчитаные по уравнению Ван-дер-Ваальса; К - критическая точка. Линия dke ("спинодаль") очерчивает область неустойчивых состояний.
Силы Ван-дер-Ваальса
СИЛЫ МЕЖМОЛЕКУЛЯРНОГО (И МЕЖАТОМНОГО) ВЗАИМОДЕЙСТВИЯ С ЭНЕРГИЕЙ 10—20 КДЖ/МОЛЬ, ВОЗНИКАЮЩИМ ПРИ ПОЛЯРИЗАЦИИ МОЛЕКУЛ И ОБРАЗОВАНИИ ДИПОЛЕЙ
Ван-дер-Ваальсовы взаимодействия; Ван-дер-Ваальсовы силы; Ван-дер-ваальсовы силы
Силы Ван-дер-Ваальса (Вандерваа́льсовы си́лыТакое написание даёт «Русский орфографический словарь: около 200 000 слов / Российская академия наук. Институт русскоrо языка им. В. В. Виноградова / Под ред. В. В. Лопатина, О. Е. Ивановой. — Изд. 4-е, испр. и доп. — М.: АСТ-ПРЕСС КНИГА, 2013. — 896 с. — (Фундаментальные словари русскою языка). — с. 68. — ISBN 978-5-462-01272-3».) — силы межмолекулярного (и межатомного) взаимодействия с энергией 10—20 кДж/моль. Этим термином первоначально обозначались все такие силы, в современной науке он обычно применяется к силам, возникающим при пол
Ван дер Ваальс (значения)
* Ван дер Ваальс, Йоханнес Дидерик — голландский физик, лауреат Нобелевской премии по физике в 1910 году.
Радиус Ван-дер-Ваальса
Вандерваальсовы радиусыТакое написание даёт «Русский орфографический словарь: около 200 000 слов / Российская академия наук. Институт русскоrо языка им. В. В. Виноградова / Под ред. В. В. Лопатина, О. Е. Ивановой. — Изд. 4-е, испр. и доп. — М.: АСТ-ПРЕСС КНИГА, 2013. — 896 с. — (Фундаментальные словари русскою языка). — с. 68. — ISBN 978-5-462-01272-3». определяют эффективные размеры атомов благородных газов. Кроме того, вандерваальсовыми радиусами считают половину межъядерного расстояния между ближайшими одноимёнными атомами, не связанными между собой химической связью и �
Википедия
Ван дер Ваальс, Йоханнес Дидерик

Йоханнес Дидерик ван дер Ва́альс (нидерл. Johannes Diderik van der Waals; 23 ноября 1837, Лейден — 8 марта 1923, Амстердам) — голландский физик. В первую очередь известен как автор уравнения Ван-дер-Ваальса, с хорошей точностью описывающего поведение реального газа.
Член Нидерландской королевской академии наук (1875), с 1896 по 1912 год — секретарь этой академии. Иностранный член Парижской академии наук (1910; корреспондент с 1900) , лауреат Нобелевской премии по физике 1910 года.


![[[Геккон]] поднимается по стеклу. [[Геккон]] поднимается по стеклу.](https://commons.wikimedia.org/wiki/Special:FilePath/Gecko Leaftail 1.jpg?width=200)
