свойство кристаллов совмещаться с собой в различных положениях путём поворотов, отражений, параллельных переносов либо части или комбинации этих операций. Симметрия внешней формы (огранки) кристалла определяется симметрией его атомного строения, которая обусловливает также и симметрию физических свойств кристалла.
На
рис. 1, а изображен
кристалл Кварца. Внешняя его форма такова, что поворотом на 120° вокруг оси 3 он может быть совмещен сам с собой (совместимое равенство).
Кристалл метасиликата натрия (
рис. 1, б) преобразуется в себя отражением в плоскости симметрии
m (зеркальное равенство). Т. о., симметрия означает возможность преобразования объекта совмещающего его с собой. Если
F (
x1,
x2,
x3) - функция, описывающая объект, например форму кристалла в трёхмерном пространстве или какое-либо его свойство, а операция
g [
x1,
x2,
x3] осуществляет преобразование координат всех точек объекта, то
g является операцией или преобразованием симметрии, а
F - симметричным объектом, если выполняются условия:
g [x1,. x2, x3] = x'1, x'2, x'3 (1, a)
F (x1, x2, x3) = F (x2, x2, x3). (1, б)
В наиболее общей формулировке симметрия - неизменность (инвариантность) объектов при некоторых преобразованиях описывающих их переменных.
Кристаллы - объекты в трёхмерном пространстве, поэтому классическая теория С. к. - теория симметрических преобразований в себя трёхмерного пространства с учётом того, что внутренняя атомная структура
кристаллов - трёхмерно-периодическая, т. е. описывается как
Кристаллическая решётка. При преобразованиях симметрии пространство не деформируется, а преобразуется как жёсткое целое (ортогональное, или изометрическое, преобразование). После преобразования симметрии части объекта, находившиеся в одном месте, совпадают с частями, находящимися в др. месте. Это означает, что в симметричном объекте есть равные части (совместимые или зеркальные).
С. к. проявляется не только в их структуре
и свойствах в реальном трёхмерном пространстве, но также
и при описании энергетического спектра электронов кристалла в импульсном пространстве (см.
Твёрдое тело), при анализе процессов дифракции рентгеновских лучей (См.
Дифракция рентгеновских лучей) в кристаллах с помощью пространства обратных длин
и т. п.
Группа симметрии кристаллов. Кристаллу может быть присуща не одна, а несколько операций симметрии. Так,
кристалл кварца (
рис. 1, а) совмещается с собой нс только при повороте на 120° вокруг оси 3 (операция
g1), ной при повороте вокруг оси 3 на 240° (операция
g2), а также при поворотах на 180° вокруг осей 2
x, 2
y, 2
w (операции
g3,
g4 и g5). Каждой операции симметрии может быть сопоставлен геометрический образ - элемент симметрии - прямая, плоскость или точка, относительно которой производится данная операция. Например, ось 3 или оси 2
x, 2
y, 2
w являются осями симметрии, плоскость
m (
рис. 1, б) - плоскостью зеркальной симметрии
и т. п. Совокупность операций симметрии [
g1,...,
gn] данного кристалла образует группу симметрии
G в смысле математической теории групп (См.
Группа). Последовательное проведение двух операций симметрии также является операцией симметрии. Всегда существует операция идентичности
g0, ничего не изменяющая в кристалле, называется отождествлением, геометрически соответствующая неподвижности объекта или повороту его на 360° вокруг любой оси. Число операций, образующих группу
G, называется порядком группы.
Группы симметрии классифицируют: по числу
n измерений пространства, в которых они определены; по числу
т измерений пространства, в которых объект периодичен (их соответственно обозначают
Gmn)
и по некоторым другим признакам. Для описания
кристаллов используют различные группы симметрии, из которых важнейшими являются пространственные группы (См.
Пространственная группа) симметрии
G33, описывающие атомную структуру
кристаллов,
и точечные группы (См.
Точечная группа) симметрии
G03, описывающие их внешнюю форму. Последние называются также кристаллографическими классами.
Симметрия огранки кристаллов. Операциями точечной симметрии являются: повороты вокруг оси симметрии порядка
N на 360°/
N (
рис. 2, а), отражение в плоскости симметрии (зеркальное отражение,
рис. 2, б), инверсия
l̅(симметрия относительно точки,
рис. 2, в), инверсионные повороты
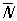
(комбинация поворота на 360°/
N с одновременной инверсией,
рис. 2, г). Вместо инверсионных поворотов иногда рассматривают зеркальные повороты
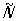
. Геометрически возможные сочетания этих операций определяют ту или иную точечную группу (
рис. 3), которые изображаются обычно в стереографической проекции. При преобразованиях точечной симметрии по крайней мере одна точка объекта остаётся неподвижной - преобразуется сама в себя. В ней пересекаются все элементы симметрии,
и она является центром стереографической проекции.
Точечные преобразования симметрии g [x1, x2, x3] = x'1, x'2, x'3 описываются линейными уравнениями:
x'1 = а11х1 + a12x2 + a13x3,
x'2 = a21x1 + a22x2 + a23x3, (2)
x'3 = a31x1 + a32x2 + a33x3,
т. е. матрицей коэффициента (aij). Например, при повороте вокруг хз на угол α = 360°/N матрица коэффициентов имеет вид:
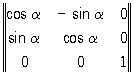
, (3)
а при отражении в плоскости x1, x2 имеет вид:
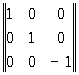
(3a)
Поскольку
N может быть любым, число групп
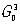
бесконечно. Однако в кристаллах ввиду наличия кристаллической решётки возможны только операции
и соответственно оси симметрии до 6-го порядка (кроме 5-го), которые обозначаются символами:
1,
2,
3,
4,
6, а также инверсионные оси:
l̅ (она же центр симметрии),
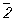
=
m (она же плоскость симметрии),
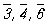
. Поэтому количество точечных кристаллографических групп, описывающих внешнюю форму
кристаллов, ограничено. Эти 32 группы С. к. приведены в таблице. В международные обозначения точечных групп входят символы основных (порождающих) элементов симметрии, им присущих. Эти группы объединяются по симметрии формы элементарной ячейки (с периодами
а,
b,
с и углами α, β, γ) в 7 сингоний кристаллографических (См.
Сингония кристаллографическая) - триклинную, моноклинную, ромбическую, тетрагональную, тригональную, гексагональную
и кубическую. Принадлежность кристалла к той или иной группе определяется гониометрически (см.
Гониометр) или рентгенографически (см.
Рентгеновский структурный анализ).
Группы, содержащие лишь повороты, описывают
кристаллы, состоящие только из совместимо равных частей. Эти группы называются группами 1-го рода. Группы, содержащие отражения, или инверсионные повороты, описывают
кристаллы, в которых есть зеркально равные части (но могут быть
и совместимо равные части). Эти группы называются группами 2-го рода.
Кристаллы, описываемые группами 1-го рода, могут кристаллизоваться в двух энантиоморфных формах, условно называемых "правой"
и "левой", каждая из них не содержит элементов симметрии 2-го рода, но они зеркально равны друг другу (см.
Энантиоморфизм,
Кварц).
Точечные группы описывают симметрию не только
кристаллов, но любых конечных фигур. В живой природе часто наблюдается запрещенная в кристаллографии симметрия с осями 5-го, 7-го порядка
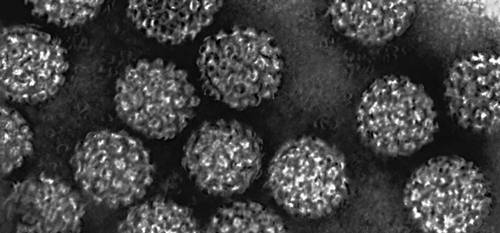
и выше. Например, для описания регулярной структуры сферических вирусов (См.
Вирусы) (
рис. 4), в оболочках которых соблюдаются кристаллографические принципы плотной укладки молекул, оказалась важной икосаэдрическая точечная группа 532.
Симметрия физических свойств. Предельные группы. В отношении макроскопических физических свойств (оптических, электрических, механических
и др.),
кристаллы ведут себя как однородная анизотропная среда, т. е. дискретность их атомной структуры не проявляется. Однородность означает, что свойства одинаковы в любой точке кристалла, однако при этом многие свойства зависят от направления (см.
Анизотропия). Зависимость от направления можно представить в виде функции
и построить указательную поверхность данного свойства (
рис. 5, см. также ст.
Кристаллооптика). Эта функция, которая может быть различной для разных физических свойств кристалла (векторной или тензорной) имеет определённую точечную симметрию, однозначно связанную с группой симметрии огранения кристалла. Она либо совпадает с ней, либо выше её по симметрии (принцип Неймана).
Многие из свойств
кристаллов, принадлежащих к определённым классам, описываются предельными точечными группами, содержащими оси симметрии бесконечного порядка, обозначаемые ∞. Наличие оси ∞ означает, что объект совмещается с собой при повороте на любой, в том числе бесконечно малый угол. Таких групп 7, они представлены на
рис. 6 образцовыми фигурами
и соответствующими символами. Т. о., всего имеется 32 + 7 = 39 точечных групп, описывающих симметрию свойств
кристаллов. Зная группу С. к., можно указать возможность наличия или отсутствия в нём некоторых физических свойств (см.
Кристаллы,
Кристаллофизика).
Обозначения и названия 32 групп точечной симметрии
----------------------------------------------------------------------------------------------------------------------------------------------------------
| Сингония | Обозначения | Название | Соотношение |
| | | | констант эле- |
| |----------------------------------------------------| | |
| | международные | по Шенфлису | | ментарной |
| | | | | ячейки |
| | | | | |
| | | | | |
| | | | | |
|---------------------------------------------------------------------------------------------------------------------------------------------------------|
| Триклинная | | С1 | Моноэдрическая | а ≠ b ≠ с |
| |----------------------------------------------------------------------------------------------------------------------------|
| | 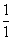 | С1 |
| С1 | Пинакоидальная
| α
≠
β
≠
γ
≠
90°
|
|---------------------------------------------------------------------------------------------------------------------------------------------------------|
| Моноклинная | 2 | С2 | Диэдрическая осевая | а ≠ b ≠ с |
| |----------------------------------------------------------------------------------------------------------------------------|
| | m | Cs | Диэдрическая безосная | α = γ = 90° |
| |----------------------------------------------------------------------------------------------------------------------------|
| | 2/m | C2h | Призматическая | β ≠ 90° |
|---------------------------------------------------------------------------------------------------------------------------------------------------------|
| Ромбическая | 222 | D2 | Ромбо-тетраэдрическая | а ≠ b ≠ с |
| |----------------------------------------------------------------------------------------------------------------------------|
| | mm | C2υ | Ромбо-пирамидальная | |
| |----------------------------------------------------------------------------------------------------------------------------|
| | mmm | D2h | Ромбо-дипирамидальная | α = β = γ = 90° |
|---------------------------------------------------------------------------------------------------------------------------------------------------------|
| Тетрагональная | 4 | C4 | Тетрагонально- | а = b ≠ с |
| | | | пирамидальная | α = β = γ = 90° |
| |-----------------------------------------------------------------------------------------------| |
| | 422 | D4 | Тетрагонально- | |
| | | | трапецоэдрическая | |
| |-----------------------------------------------------------------------------------------------| |
| | 4/m | C4h | Тетрагонально- | |
| | | | дипирамидальная | |
| |-----------------------------------------------------------------------------------------------| |
| | 4mm | C4υ | Дитетрагонально- | |
| | | | пирамидальная | |
| |-----------------------------------------------------------------------------------------------| |
| | 4/mmm | D4h | Дитетрагонально- | |
| | | | дипирамидальная | |
| |-----------------------------------------------------------------------------------------------| |
| | 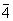 | S4 |
| S4 | Тетрагонально-
| |
| | | | тетраэдрическая | |
| |-----------------------------------------------------------------------------------------------| |
| | 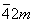 | D2d |
| D2d | Тетрагонально-
| |
| | | | скаленоэдрическая | |
|---------------------------------------------------------------------------------------------------------------------------------------------------------|
| Тригональная | 3 | C3 | Тригонально- | а = b = с |
| | | | пирамидальная | α = β = γ ≠ 90° |
| |-----------------------------------------------------------------------------------------------| |
| | 32 | D3 | Тригонально- | |
| | | | трапецоэдрическая | |
| |-----------------------------------------------------------------------------------------------| |
| | 3m | C3υ | Дитригонально- | |
| | | | пирамидальная | |
| |-----------------------------------------------------------------------------------------------| |
| | 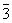 | C3i |
| C3i | Ромбоэдрическая
| |
| |-----------------------------------------------------------------------------------------------| |
| | 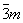 | D3d |
| D3d | Дитригонально-
| |
| | | | скаленоэдрическая | |
| |-----------------------------------------------------------------------------------------------| |
| | 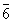 | C3h |
| C3h | Тригонально-
| |
| | | | дипирамидальная | |
|---------------------------------------------------------------------------------------------------------------------------------------------------------|
| Гексагональная
| 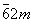 | D3h |
| D3h | Дитригонально-
| а =
b ≠
с |
| | | | дипирамидальная | α = β = 90° |
| |-----------------------------------------------------------------------------------------------| γ = 120° |
| | 6 | C6 | Гексагонально- | |
| | | | пирамидальная | |
| |-----------------------------------------------------------------------------------------------| |
| | 62 | D6 | Гексагонально- | |
| | | | трапецоэдрическая | |
| |-----------------------------------------------------------------------------------------------| |
| | 6/m | C6h | Гексагонально- | |
| | | | дипирамидальная | |
| |-----------------------------------------------------------------------------------------------| |
| | 6mm | C6υ | Дигексагонально- | |
| | | | пирамидальная | |
| |-----------------------------------------------------------------------------------------------| |
| | 6/mmm | D6h | Дигексагонально- | |
| | | | дипирамидальная | |
|---------------------------------------------------------------------------------------------------------------------------------------------------------|
| Кубическая | 23 | T | Тритетраэдрическая | а = b = с |
| |-----------------------------------------------------------------------------------------------| α = β = γ = 90° |
| | m3 | Th | Дидодекаэдрическая | |
| |-----------------------------------------------------------------------------------------------| |
| | 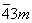 | Td |
| Td | Гексатетраэдрическая
| |
| |-----------------------------------------------------------------------------------------------| |
| | 43 | O | Триоктаэдрическая | |
| |-----------------------------------------------------------------------------------------------| |
| | m3m | Oh | Гексоктаэдрическая | |
----------------------------------------------------------------------------------------------------------------------------------------------------------
Пространственная симметрия атомной структуры кристаллов (кристаллической решётки) описывается пространственными группами симметрии
G33. Характерными для решётки операциями являются три некомпланарных переноса
а,
b,
с, называемых трансляциями, которые задают трёхмерную периодичность атомной структуры
кристаллов. Сдвиг (перенос) структуры на векторы
a1,
b2,
c3 или любой вектор
t =
p1a1 +
p2b2 +
p3c3, где
p1,
p2,
p3 - любые целые положительные или отрицательные числа, совмещает структуру кристалла с собой,
и следовательно, является операцией симметрии, удовлетворяющей условиям (
1, а, б). Параллелепипед, построенный на векторах
а,
b и c, называется параллелепипедом повторяемости или элементарной ячейкой кристалла (
рис. 7, а, б). В элементарной ячейке содержится некоторая минимальная группировка атомов, "размножение" которой операциями симметрии, в том числе трансляциями, образует кристаллическую решётку. Элементарная ячейка
и размещение в ней атомов устанавливается методами рентгеновского структурного анализа (См.
Рентгеновский структурный анализ), электронографии (См.
Электронография) или нейтронографии (См.
Нейтронография).
Вследствие возможности комбинирования в решётке трансляций и операций точечной симметрии в группах G33 возникают операции и соответствующие им элементы симметрии с трансляционной компонентой - винтовые оси различных порядков и плоскости скользящего отражения (рис. 2, д).
Всего известно 230 пространственных (фёдоровских) групп симметрии
G33,
и любой
кристалл относится к одной из этих групп. Трансляционные компоненты элементов микросимметрии макроскопически не проявляются, например винтовая ось в огранке
кристаллов проявляется как соответствующая по порядку простая поворотная ось. Поэтому каждая из 230 групп
G33 макроскопически сходственна с одной из 32 точечных групп. Например, точечной группе
mmm или
D2h сходственны 28 пространственных групп. Совокупность переносов, присущих данной пространственной группе, есть её трансляционная подгруппа, или
Браве решётка; таких решёток существует 14.
Симметрия слоев и цепей. Для описания плоских или вытянутых в одном направлении фрагментов структуры
кристаллов могут быть использованы группы
G23 - двумерно периодические
и G13 - одномерно периодические в трёхмерном пространстве. Эти группы играют важную роль в изучении биологических структур
и молекул. Например, группы
G23 описывают строение биологических мембран (См.
Мембраны биологические), группы
G13 - цепных молекул (
рис. 8, а) палочкообразных вирусов (См.
Вирусы), трубчатых
кристаллов глобулярных белков (См.
Белки) (
рис. 8, б), в которых молекулы уложены согласно спиральной (винтовой) симметрии, возможной в группах
G13.
Обобщённая симметрия. В основе определения симметрии лежит понятие равенства (
1, б) при преобразовании (
1, а). Однако физически (
и математически) объект может быть равен себе по одним признакам
и не равен по другим. Например, распределение ядер
и электронов в кристалле
Антиферромагнетика можно описать с помощью обычной пространственной симметрии, но если учесть распределение в нём магнитных моментов (
рис. 9), то "обычной", классической симметрии уже недостаточно. К подобного рода обобщениям симметрии относится антисимметрия
и цветная симметрия. В антисимметрии в дополнение к трём пространственным переменным
x1,
x2,
x3 вводится добавочная, 4-я переменная
x4 = ± 1. Это можно истолковать таким образом, что при преобразовании (
1, а) функция
F может быть не только равна себе, как в (
1, б), но
и изменить знак. Условно такую операцию можно изобразить изменением цвета (
рис. 10). Существует 58 групп точечной антисимметрии
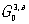 и
и 1651 пространственная группа антисимметрии
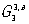
(шубниковских групп). Если добавочная переменная приобретает не два значения, а несколько (возможны числа 3, 4, 6, 8,..., 48), то возникает "цветная" симметрия Белова. Так, известна 81 точечная группа
G03, ц. Основные приложения обобщённой симметрии в кристаллографии - описание магнитных структур.
Др. обобщения симметрии: симметрия подобия, когда равенство частей фигуры заменяется их подобием (
рис. 11), криволинейная симметрия, статистическая симметрия, вводимая при описании структуры разупорядоченных
кристаллов, твёрдых растворов (См.
Твёрдые растворы), жидких
кристаллов (См.
Жидкие кристаллы),
и др.
Лит.: Шубников А. В., Копцик В. А., Симметрия в науке и искусстве, 2 изд., М., 1972; Вейль Г., Симметрия, пер. с англ., М., 1968; Федоров Е. С.. Симметрия и структура кристаллов, [М.], 1949; Шубников А. В., Симметрия и антисимметрия конечных фигур, М., 1951.
Б. К. Вайнштейн.
Рис. 4. Cферический вирус (электронно-микроскопический снимок, увеличено).
Рис. 1. а - кристалл кварца: 3 - ось симметрии 3-го порядка, 2x ,2y, 2w - оси второго порядка; б - кристалл водного метасиликата натрия: m - плоскость симметрии.
Рис. 2. Простейшие операции симметрии: а - поворот; б - отражение; в - инверсия; г - скользящее отражение; д - винтовой поворот 4-го порядка.
Рис. 3. Примеры кристаллов, принадлежащих к разным точечным группам или кристаллографическим классам: а - к классу m (одна плоскость симметрии); б - к классу с (один центр симметрии); в - к классу 2 (одна ось симметрии 2-го порядка); г - к классу 6 (одна зеркальная ось 6-го порядка).
Рис. 5. Поверхность, описывающая оптическую активность кристалла кварца; знаки (+) и (-) указывают противоположные направления вращения плоскости поляризации.
Рис. 6. Фигуры, иллюстрирующие предельные группы симметрии.
Рис. 7. Элементарные ячейки кристаллов: а - K2PtCl6; б - CuCl2․2H2O.
Рис. 8. Объекты со спиральной симметрией: а - молекула ДНК; б - трубчатый кристалл белка фосфорилазы (электронномикроскопический снимок, увеличено).
Рис. 9. Распределение магнитных моментов (стрелки) в элементарной ячейке кристалла Cr2O3.
Рис. 10. Фигура, описываемая точечной группой антисимметрии.
Рис. 11. Фигура, обладающая симметрией подобия.



![[[Почтовая марка]] [[СССР]], [[1966 год]]: <br /> VII международный конгресс кристаллографов [[Почтовая марка]] [[СССР]], [[1966 год]]: <br /> VII международный конгресс кристаллографов](https://commons.wikimedia.org/wiki/Special:FilePath/The Soviet Union 1966 CPA 3307 stamp (7th Crystallography International Congress (12-21.07, Moscow). Emblem - Crystals. Artificially Grown up Crystal of Quartz and Structure of Scheelite Mineral).jpg?width=200)

![Лёд [[Байкал]]а Лёд [[Байкал]]а](https://commons.wikimedia.org/wiki/Special:FilePath/Baikal ice on sunset.jpg?width=200)
![Лёд на реке [[Дон]] Лёд на реке [[Дон]]](https://commons.wikimedia.org/wiki/Special:FilePath/Frozen Don River in cold Russian winter, Rostov-on-Don, Russia.jpg?width=200)

![[[Иглу]] [[Иглу]]](https://commons.wikimedia.org/wiki/Special:FilePath/Igloo.jpg?width=200)


![Образование [[нилас]]а Образование [[нилас]]а](https://commons.wikimedia.org/wiki/Special:FilePath/Nilas in arctic.jpg?width=200)
