Введите слово или словосочетание на любом языке 👆
Язык:
Перевод и анализ слов искусственным интеллектом ChatGPT
На этой странице Вы можете получить подробный анализ слова или словосочетания, произведенный с помощью лучшей на сегодняшний день технологии искусственного интеллекта:
- как употребляется слово
- частота употребления
- используется оно чаще в устной или письменной речи
- варианты перевода слова
- примеры употребления (несколько фраз с переводом)
- этимология
Что (кто) такое УРАН - определение
СПИСОК ЗНАЧЕНИЙ СЛОВА УРАН
Уран (значения)
Найдено результатов: 76
Уран
Уран U (Uran, Uranium; при O=16 атомн. вес U=240) - элемент снаибольшим атомным весом; все элементы, по атомному весу, помещаютсямежду водородом и ураном. Это тяжелейший член металлической подгруппы VIгруппы периодической системы. Важнейшие кислородные соединения У., как идля серы, суть двуокись UO2 и трехокись UO3 Оба окисла представляютвысокий тип; но, благодаря большому атомному весу элемента, им свойственосновной характер, вовсе не соединяется со щелочами, а только скислотами, образуя соли, в которых У. является четырехвалентнымметаллом, напр. cернокислый У., U(SO4)2 9H2O, кристаллизирующийся изводных растворов в виде зеленоватых ромбических призм. UО3 дает скислотами только основные соли, напр. азотнокислый уранил (UO2)(NO3)26H2O - лимонно-желтые, флюоресцирующие ромбические призмы, хорошорастворимые в воде и расплывающиеся на воздухе. В таких соляхдвухвалентный остаток трехокиси, (UO2)II, играет роль как бы особогометалла; при соляном обмене он целиком переходит из частицы в частицу,вследствие чего и получил особое название - уранил (Аналогичные терминыупотребляются и в номенклатуре других элементов: хромил (CrO2)II,сульфурил (SO2)II, карбонил (СО)II; но там они не имеют того значения,как для соединений У., что ясно из нижеследующего. В свободном виде этот уранил есть не что иное, как двуокись, котораяпри первоначальном изучении соединений У. (Клапрот, 1789) была принятаза элемент, благодаря своему металлическому виду и неспособностивосстановляться общепринятыми в то время способами. Металлический У. былдобыть только спустя более 50 лет после того (Пелиго, 1842). Существуютмногочисленные двойные соли уранила. Трехокись не лишена, однако, иангидридных свойств, как и подобает окислу аналогичному с СгO3, МоO3,WO3; для ее эти свойства только наиболее ослаблены, как это имеет местодля МоO3 сравнительно с СгОз и для WO3 сравнительно с МоO3.Урановокислые соли щелочных металлов осаждаются из растворов содейуранила едкими щелочами, а урановокислые соли щелочноземельных и прочихметаллов осаждаются аммиаком из смеси растворов солей уранила и солейсоответствующих металлов. почти все урановокислые соли аналогичны посоставу хромпику, т. е. отвечают кислоте H2U2O7. Так назыв. зеленаяокись У., U3O8, представляет урановокислый У., именно U3O8 = UO2(UO3)2 =U(UO4)2 т. е. это средняя соль У. и урановой кислоты; здесьчетырехвалентный У. замещает четыре водорода в двух частицах нормальнойурановой кислоты H2UO4, а черная окись У., U2O5, есть основная соль тойже кислоты, U2O5=(UO)UO4. Если прибавлять очень разведенную перекисьводорода к раствору азотнокислого уранила, то получается желтовато белыйосадок UO42Н2О - это над-урановая кислота; прибавляя вместе с перекисьюводорода и едкий натр, получают кристаллический, золотисто-желтыйпорошок - над-урановокислый натрий Na4UO88H2O. На основании способностик расщеплению гидролитического характера этой и других подобных солейможно полагать (Меликов и Писаржевсмй), что вообще в соединениях этогорода присутствуют сочетания UO4 с перекисями металлов. Сам надурановыйангидрид обладает точно также перекисным характером, что можно выразитьтакой формулой O2(UO2) - перекись уранила. У. принадлежит к числу довольно редких элементов; обычным источникомего соединений служит смоляная обманка или смоляная урановая руда,которая встречается в рудных месторождениях Саксонии и Богемии, вокрестностях Адрианополя, в Корнваллисе и нек. др. местах и содержитупомянутой зеленой окиси от 40 до 90%; кроме того, известны урановаяслюда - двойная фосфорноурановокальциевая соль, желтого цвета,(UO2)2Ca(PO4)28H2O, торбернит - зеленая фосфорноураново-медная соль(UO2Cu(PO4)2 8H2O, либигит - двойная угле-урановокадьцевая сольUO2CO3CaCO3 10H2O, урано-танталит или самарскит, где присутствуютниобиевокислый и танталовокислый уранил, клевеит и некот. друг.минералы. Иногда содержащие У. минералы заключают в своем составе редкиеметаллы, напр., тоpий; из них выделен также аргон и гелий, вместе сгазообразным азотом, при чем осталось невыясненным, в какой форме этиэлементы здесь находятся. Смоляная руда содержит различные примеси, аименно свинцовый блеск, сернистое железо, мышьяк, силикаты и проч. Приобработке руду прежде всего обжигают для удаления большей части серы имышьяка, затем измельчают, промывают слабой соляной кислотой иобрабатывают азотной кислотой, при чем в раствор переходит азотнокислыйуранил (UO2)(NO3)2. раствор выпаривают досуха и извлекают водой(UO2)(NO3)2; зеленовато-желтый раствор фильтруют и подвергают испарению,при чем происходит осаждение (UO2)(NO3)2 в виде лучистокристаллическоймассы (состав дан выше). Для полного очищения (UO2)(NO3)2перекристаллизовывают из эфира, в котором он хорошо растворим. Если нагревать азотнокислый уранил при 250°, пока не прекратитсявыделение кислых паров, то он превращается в трехокись UO3 -буровато-желтый порошок. Та же соль при испарении ее раствора вабсолютном спирте, после умеренного нагревания, превращается в гидраттрехокиси UO2(OH)2 + Н2О, который представляет желтую массу, теряющуюпри 100°, а в пустоте и при обыкн. темп., кристаллизационную воду (т. е.получается H2UO4). При 400° этот гидрат теряет всю воду и частькислорода, превращаясь в зеленую окись U3O8, которая при высокойтемпературе есть наиболее постоянный окисел У. Очень сильное каление,при быстром затем охлаждении - особенно в струе индифферентного газа -может повести к дальнейшей потере кислорода и образованию черной окисиU205 и даже UO2; прокаливание в струе кислорода и охлаждение в том жегазе всегда приводит к чистой U3O8 (Это - по Кл. Циммерману, которыйвообще отрицает постоянство состава черной окиси). При нагреваниизеленой окиси или щавелевокислого уранила в струе водорода возникаетдвуокись У., UO2 в виде пирофорного порошка бурого или медно-красногоцвета, уд. веса 10, 15; полученная при восстановлении углем, онапредставляет черный кристаллический порошок; после промывки разбавленнойсоляной кислотой, из сплава с бурой получается в виде черных октаэдров,изоморфных с двуокисью тория. При нагревании на воздухе UO2 сновасгорает в U3O8; в крепких кислотах растворяется, образуя зеленые соли.Из соляных растворов едкие щелочи осаждают гидрат двуокиси -красно-бурые хлопья, чернеющие при кипячении смеси. Гидрат легкорастворяется даже в разведенных кислотах. Соли двуокиси на воздухе легкоокисляются в соли уранила. Из соединений У. с галоидами особый интерес представляетчетыреххлористый У., UCI4; возможность получения его при накаливаниисмеси UO2 с углем в струе хлора впервые показала сложность уранила, аплотность пара этого соединения, как и UВr4, окончательно удостоверила(Циммерман, 1881) принятый ныне атомный вес У., предложенный Д. И.Менделеевым (1871) на основании требований периодического закона ( Современи Пелиго У. уподобляли железу, что приводит к таким формуламокислов У.: UO, U203 и V3O4 при U=120. Аналогия соединений железных сурановыми в самом деле существует, но она далеко не такова, чтобы можнобыло относить железо и У. к одной группе. Удвоение атомного веса впервыеуказало истинное положение У. среди других элементов. Плотность пара прикрасном калении оказалась равной, по отношению к воздуху, для UCI4 13,3, а для Ubr4 19, 5. Теплоемкость У. точно так же отвечает предложенномуМенделеевым атомному весу (см. ниже)). UCI4 образуется путем сжиганияпорошкообразного У. в хлоре или при нагревании UO2 в хлористом водороде,а проще всего при накаливании какого-либо окисла У., смешанного с углемв струе сухого хлора, при чем возникает вместе с СО и СО2 красный парUCI4, сгущающийся в более холодной части прибора в темнозеленые, почтичерные, блестящие октаэдры правильной системы. UCI4 сильно дымит навоздухе и быстро расплывается; в воде растворяется при выделении тепла,образуя изумрудно-зеленый раствор, который, если не был нагреваем,содержит неразложенный UC4 и обладает восстановительными свойствами -превращает FeCI3 в FeCI2, осаждает металлическое золото и серебро из ихрастворов; но уже при кипячении происходит выделение НСI, полное жеиспарение приводит к гидрату двуокиси. Известно соединение с аммиаком3UCI44NH3. При нагревании UCI4 в струе водорода получается UCI3,красновато-бурый порошок, трудно летучий и растворяющийся легко в воде скрасным цветом; такой раствор затем, при выделении водорода, постепеннопревращается в зеленый. При нагревании UCI4 в струе хлора возникаетнесколько более летучий UCI5 (Роско), в виде темных игольчатыхкристаллов, отражающих металлически-зеленый цвет, а в проходящем светекажущихся рубиново красными; при быстром токе хлора UCI5 получается вформе бурого, легкого порошка. Ucl5 очень гигроскопичен, в водерастворяется с желтоватозеленым цветом, в атмосфере СО2 начинаетразлагаться уже при 120° на UCI4 и свободный хлор, а при 235° разложениестановится полным. С UCI4 сходно во многих отношениях соответственноебромистое соединение; йодистое известно только в растворе, а фтористоенерастворимо в воде и получается в виде объемистого зеленого порошка,если прибавить плавиковой кислоты к раствору UCI4. Известны двойныесоединения KUF5 и Na2UCI6 (Это кристаллическое вещество, яблочнозеленогоцвета, получается (Муассан), когда при темно-красном калении пропускаютнад поваренной солью пары UCI4; оно плавится при 390°, растворимо вхолодной воде и спиртом разлагается. Подвергая расплавленный Na2UCl6электролизу, Муассан получил порошок металлического У.; нагреваниеNa2UCI6 с металлическим натрием в железном, закрывающемся винтовоюкрышкою сосуде привело к тому же результату при сильно-экзотермическомвзаимодействии.). Бинарных галоидных соединений шестивалентного У.неизвестно, а существуют только кислородо-галоидные соединения, как идля хрома или серы (если не считать SF6) - это фтористый, хлористый ибромистый уранилы. UO2СI2 получается, если нагревать до красного каленияUO2 в струе сухого хлора; трубка наполняется оранжево-желтым паром этогосоединения, который осаждается на стенках в виде желтой кристаллическоймассы, легкоплавкой, но трудно летучей. UO2CI2 растворяется в воде,спирте, эфире и при испарении водного раствора кристаллизуется ссодержанием воды - UO2CI2H2O; те же кристаллы можно получить и израствора UO3 в соляной кислоте. Очевидно, столь определенныехлорангидридные свойства CrO2CI2 совершенно исчезли у его аналога; это -соль соляной кислоты, хлористый уранил. Таково влияние высокого атомноговеса У. Существуют кристаллические двойные соли такого состава:аммонийная и калиевая 2NH4CI UO2CI2 2H20, 2KCI UO2CI2 2H2O, а дляфтористого уранила более сложная 3KFUO2F2. Если нагревать металлический У. в парах серы, то он загорается ипревращается в сернистый У. US2, серовато-черный порошок, которыйделается кристаллическим при прокаливании без доступа воздуха. То жесоединение получается при красном калении из UCI4 в струе сероводорода;в виде гидрата оно осаждается сернистым аммонием из растворов солей У.Под влиянием влажного воздуха US2 выделяет H2S и превращается в UO2S,сернистый уранил. UO2SH2O, в виде темно-бурого осадка, получается и придействии сернистого аммония на растворы солей уранила. При 1000°металлический У. поглощает азот (Муассан), превращаясь в азотистый У,желтого цвета и неизвестного пока состава. Черный порошок другогоазотистого соединения U3N4 возникает, еслинагревать смесь UCI4 снашатырем в атмосфере аммиака.. Карбид У., U2C3, получается (Муассан)при сплавлении 500 гр. зеленой окиси с 60 гр. угля (из сахара) вэлектрической печи в течение 8 - 10 минут током в 900 ампер и 50 вольт;это - металлического вида кусочки с кристаллическим изломом и внешнимвидом висмута; уд. в. 11,28 (определен в бензине). Карбид разлагаетсяводою таким образом, что около 1/3, углерода выделяется в видегазообразных углеводородов (анализ газов показал 78 - 81 % метана, 5 - 7% этилена, 0,2 - 0,7 % ацетилена и 13,5 - 15,0% водорода), а остальнойуглерод находится в составе жидких и твердых углеводородов, образующихсявместе с газообразными. Твердость карбида не особенно велика: он чертитстекло и горный хрусталь, но не корунд; при ударе твердым телом дает,подобно металлическому У., искры; при растирании в агатовой ступке можетзагореться. Металлический У. впервые был добыт Пелиго действием натрия или калияна UCI4, и именно в присутствии хлористого калия. В недавние годыМуассан повторил старые опыты и применил свой метод получения металлапутем восстановления зеленой окиси У. углем в электрической печи.Последний путь оказался наиболее простым: смесь из 500 гр. U3O8 и 40 гр.угля впрессовывается в угольный тигель и подвергается действию повольтовой дуге от тока в 800 ампер и 45 вольт в продолжении 7 - 8 минут;в результате около 350 гр. сплавленного металла, который почти несодержит углерода или даже совершенно свободен от него, но тогда можетсодержать некоторую примесь оксидов У. Освободить У. от углерода удаетсяпутем продолжительного нагревания в тигле с набойкою, которая содержитU3O8; этот тигель помещают в другом тигле и, чтобы избежатьвозникновения азотистого У., засыпают его титанистым материалом. ЧистыйУ. имеет белый цвет без синеватого огонька, свойственного железу,которому подобен по блеску; легко поддается действию напилка и хорошополируется; уд. вес 18,7 при 14°; теплоемкость 0,02765 (следовательно,атомная теплоемкость 6,6). В форме сплошного куска У. очень медленноизменяется на воздухе; полированная поверхность постепенно делаетсястально-синею и, наконец, черною; под водою он точно также покрываетсяслоем окисла. В разведенной серной кислоте У. растворяется, привыделении водорода, медленно при обыкновенной температуре и быстро принагревании, в соляной же кислоты - быстро уже на холоду; получаются солидвуокиси. В виде порошка У. окисляется на воздухе и разлагает воду, то идругое - при обыкновенной температуре - медленно; при 100° водуразлагает быстрее и при 170° загорается в кислороде; в атмосфере фторазагорается при обыкновенной температуре, в хлоре при 180°, в парах бромапри 210°, йода - при 260° и серы - при 500°. При накаливании У. плавитсяи улетучивается легче железа. Не притягивается магнитом, если несодержит железа. Практические применения соединений У. довольно ограниченны. Урановаяжелтая краска, именно ураново-кислый натрий Na2U2O7 употребляется встеклоделии, так как способна сплавляться со стеклом, сообщая ему желтыйцвет с зеленым рефлексом - урановое стекло. Двуокись У. окрашивает стеклянные сплавы в черныйцвет и употребляется, как черная краска для живописи по фарфору. Впоследние годы была открыта (Беккерель, 1896 г.) для У. и различныхсоединений его способность испускать, даже после продолжительногохранения в темноте, особые лучи, которые могут проникать чрезнепрозрачные тела, действовать на фотографическую пластинку, производитьразряд наэлектризованных тел и проч. Это свойство приобрело в настоящеевремя название радиоактивности и принадлежит некоторым малоизученным,почти не открытым еще элементам (радий, полонии, актиний), соединениякоторых в ничтожно малых количествах примешаны к урановым и другимрадиоактивным минералам. Азотнокислый уранил употребляется для объемногоопределения фосфорной кислоты. Растворимые соли У. ядовиты; введениерастворов их под кожу, уже в малых дозах, вызывает явления сахарнойболезни. С. С. Колотов.
Уран
м.
Одна из девяти - седьмая от Солнца - больших планет Солнечной системы.
Одна из девяти - седьмая от Солнца - больших планет Солнечной системы.
уран
муж. воинский крик башкир, киргизов, татар, различный, по племенам и коленам; у одного племени киргизов искони уран: орел! у другого: имя предводителяи пр. От урмак, бить, отчего и наше ура, бей?
II. УРАН муж. предпоследняя, осьмая от солнца планета; названье из ·*греч. боговщины.
| Уран и ураний, один из неиздельных металов. Уранит муж. ископаемое, содержащее сей метал. Урановая окись. - руда. Уранография жен. часть астрономии, описание звездного неба, всех небесных светил, небесная география.
уран
УРАН
U (uranium), металлический химический элемент семейства актиноидов, которые включают Ac, Th, Pa, U и трансурановые элементы (Np, Pu, Am, Cm, Bk, Cf, Es, Fm, Md, No, Lr). Уран приобрел известность благодаря использованию его в ядерном оружии и атомной энергетике. Оксиды урана применяются также для окрашивания стекла и керамики.
См. также:
Уран
I
Ура́н
в древнегреческой мифологии бог неба, супруг Геи (Земли), отец титанов, циклопов и сторуких исполинов; был оскоплен и свергнут собственным сыном Кроносом.
II
Ура́н
седьмая по удалённости от Солнца большая планета Солнечной системы; астрономический знак 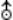 или
или 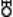 . Относится к числу планет-гигантов. Открыт В. Гершелем (См. Гершель) в 1781; случайно наблюдался и ранее, но оставался нераспознанным среди звёзд. Движется вокруг Солнца на среднем расстоянии от него 19,19 а. е. по орбите, близкой к круговой. Эксцентриситет орбиты равен 0,047, наклон плоскости орбиты У. к плоскости эклиптики составляет всего лишь 0,77°. Полный оборот вокруг Солнца У. совершает за 84,015 года, или 30 685 земных сут. Синодический период У., в течение которого повторяются противостояния и соединения с Солнцем, составляет 369,7 сут. Будучи достаточно ярким объектом (около 6-й звёздной величины), У. легко наблюдается в бинокль, но для того, чтобы уверенно заметить диск, нужен телескоп с увеличением не менее 60 раз. Невооружённым глазом едва различим. Видимый поперечник У. меняется в пределах от 3,4'' до 4,3''. Истинный экваториальный диаметр У. равен 50700 км, или 3,98 диаметра Земли. Объём У. в 61 раз превышает объём Земли, масса же его составляет 14,56 массы Земли, так что средняя его плотность мала и равна 1,32 г /см3, что характерно для планет-гигантов. Ускорение силы тяжести на экваторе У. равно 1040 см/сек2 минус 60 см/сек2 за счёт центробежного ускорения, а вторая космическая скорость - 22 км/сек.
. Относится к числу планет-гигантов. Открыт В. Гершелем (См. Гершель) в 1781; случайно наблюдался и ранее, но оставался нераспознанным среди звёзд. Движется вокруг Солнца на среднем расстоянии от него 19,19 а. е. по орбите, близкой к круговой. Эксцентриситет орбиты равен 0,047, наклон плоскости орбиты У. к плоскости эклиптики составляет всего лишь 0,77°. Полный оборот вокруг Солнца У. совершает за 84,015 года, или 30 685 земных сут. Синодический период У., в течение которого повторяются противостояния и соединения с Солнцем, составляет 369,7 сут. Будучи достаточно ярким объектом (около 6-й звёздной величины), У. легко наблюдается в бинокль, но для того, чтобы уверенно заметить диск, нужен телескоп с увеличением не менее 60 раз. Невооружённым глазом едва различим. Видимый поперечник У. меняется в пределах от 3,4'' до 4,3''. Истинный экваториальный диаметр У. равен 50700 км, или 3,98 диаметра Земли. Объём У. в 61 раз превышает объём Земли, масса же его составляет 14,56 массы Земли, так что средняя его плотность мала и равна 1,32 г /см3, что характерно для планет-гигантов. Ускорение силы тяжести на экваторе У. равно 1040 см/сек2 минус 60 см/сек2 за счёт центробежного ускорения, а вторая космическая скорость - 22 км/сек.
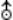 или
или 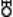 . Относится к числу планет-гигантов. Открыт В. Гершелем (См. Гершель) в 1781; случайно наблюдался и ранее, но оставался нераспознанным среди звёзд. Движется вокруг Солнца на среднем расстоянии от него 19,19 а. е. по орбите, близкой к круговой. Эксцентриситет орбиты равен 0,047, наклон плоскости орбиты У. к плоскости эклиптики составляет всего лишь 0,77°. Полный оборот вокруг Солнца У. совершает за 84,015 года, или 30 685 земных сут. Синодический период У., в течение которого повторяются противостояния и соединения с Солнцем, составляет 369,7 сут. Будучи достаточно ярким объектом (около 6-й звёздной величины), У. легко наблюдается в бинокль, но для того, чтобы уверенно заметить диск, нужен телескоп с увеличением не менее 60 раз. Невооружённым глазом едва различим. Видимый поперечник У. меняется в пределах от 3,4'' до 4,3''. Истинный экваториальный диаметр У. равен 50700 км, или 3,98 диаметра Земли. Объём У. в 61 раз превышает объём Земли, масса же его составляет 14,56 массы Земли, так что средняя его плотность мала и равна 1,32 г /см3, что характерно для планет-гигантов. Ускорение силы тяжести на экваторе У. равно 1040 см/сек2 минус 60 см/сек2 за счёт центробежного ускорения, а вторая космическая скорость - 22 км/сек.
. Относится к числу планет-гигантов. Открыт В. Гершелем (См. Гершель) в 1781; случайно наблюдался и ранее, но оставался нераспознанным среди звёзд. Движется вокруг Солнца на среднем расстоянии от него 19,19 а. е. по орбите, близкой к круговой. Эксцентриситет орбиты равен 0,047, наклон плоскости орбиты У. к плоскости эклиптики составляет всего лишь 0,77°. Полный оборот вокруг Солнца У. совершает за 84,015 года, или 30 685 земных сут. Синодический период У., в течение которого повторяются противостояния и соединения с Солнцем, составляет 369,7 сут. Будучи достаточно ярким объектом (около 6-й звёздной величины), У. легко наблюдается в бинокль, но для того, чтобы уверенно заметить диск, нужен телескоп с увеличением не менее 60 раз. Невооружённым глазом едва различим. Видимый поперечник У. меняется в пределах от 3,4'' до 4,3''. Истинный экваториальный диаметр У. равен 50700 км, или 3,98 диаметра Земли. Объём У. в 61 раз превышает объём Земли, масса же его составляет 14,56 массы Земли, так что средняя его плотность мала и равна 1,32 г /см3, что характерно для планет-гигантов. Ускорение силы тяжести на экваторе У. равно 1040 см/сек2 минус 60 см/сек2 за счёт центробежного ускорения, а вторая космическая скорость - 22 км/сек. Фигура У. сильно сжата у полюсов (сжатие - около 1: 33), что отражает факт быстрого его вращения вокруг оси: период осевого вращения У. составляет 10,8 ч. Поскольку на диске У. не заметно никаких деталей, установить факт его вращения из прямых наблюдений невозможно. Период вращения У. установлен по периодическим изменениям его блеска с амплитудой до 0,15 звёздной величины, а также по величине смещения линий в его спектре вследствие эффекта Доплера, что позволяет определить линейную скорость вращения У. на его экваторе. В отличие от большинства планет, у которых осевое вращение, если смотреть на планету со стороны Сев. полюса, происходит против часовой стрелки, т. е. в ту же сторону, в которую движется и сама планета вокруг Солнца, У. (как и Венера) вращается в сторону, противоположную орбитальному движению; ось вращения У. лежит почти в плоскости орбиты, составляя с нормалью к орбите угол 98°.
Из-за большого удаления от Солнца У. получает от него очень мало света и тепла - почти в 370 раз меньше, чем Земля, но его отражательная способность очень велика - самая высокая среди планет: сферическое Альбедо У. равно 0,93, геометрическое альбедо - 0,57. Если У. столь же эффективно отражает всё тепловое излучение Солнца, то его температура на поверхности должна быть очень низкой - ниже 90 К (-180 °С); это подтверждается измерениями в инфракрасной области спектра, где средняя температура оказалась равной всего лишь 55 ± 3 К. В то же время температура, измеренная в сантиметровом диапазоне, заметно превышает 100 К, что свидетельствует о существовании потока тепла из недр планеты. Большое альбедо У. говорит о наличии мощной атмосферы. Спектроскопическим методом на планете обнаружен молекулярный водород H2 мощностью 100 км-атм над уровнем облачного слоя и метан CH4 мощностью от 3 до 150 км-атм (по разным оценкам). Давление атмосферы на уровне облаков оценивается в 3 атм. Теоретические исследования внутреннего строения У. привели к следующим результатам: внешняя газовая оболочка состоит из газов H2, Не, CH4, общая масса которых составляет около 10\% полной массы планеты; толщина оболочки - 27\% радиуса У.; ниже находится жидкое ядро, состоящее преимущественно из воды.
У. имеет 5 спутников, которые движутся в экваториальной плоскости У. в направлении вращения планеты. Все они слабы и доступны наблюдениям лишь с помощью крупных телескопов. Два спутника, более удалённые и самые яркие, - Титания и Оберон - были открыты Гершелем в 1787, менее яркие - Ариель и Умбриэль - У. Ласселлом в 1851 и, наконец, самый близкий к планете спутник - Миранда - амер. астрономом Дж. Койпером в 1948 фотографическим путём (блеск 16,5 звёздной величины). Размеры спутников можно лишь грубо оценить по их блеску: самый крупный из них - Титания - имеет диаметр между 0,5 и 1,3 тыс. км, самый малый - Миранда - от 150 до 500 км.
Лит.: Мороз В. И., Физика планет, М., 1967; Мартынов Д. Я.. Планеты. Решенные и нерешенные проблемы, М., 1970.
Д. Я. Мартынов.
III
Ура́н (лат. Uranium)
U, радиоактивный химический элемент III группы периодической системы Менделеева, относится к семейству актиноидов (См. Актиноиды), атомный номер 92, атомная масса 238,029; металл. Природный У. состоит из смеси трёх изотопов: 238U - 99,2739\% с периодом полураспада T1/2 = 4,51·109 лет, 235U - 0,7024\% (T1/2 = 7,13·108 лет) и 234U - 0,0057\% (T1/2 = 2,48·105 лет). Из 11 искусственных радиоактивных изотопов с массовыми числами от 227 до 240 долгоживущий - 233U (T1/2 = 1,62·105лет); он получается при нейтронном облучении тория. 238U и 235U являются родоначальниками двух радиоактивных рядов.
Историческая справка. У. открыт в 1789 нем. химиком М. Г. Клапротом и назван им в честь планеты Уран, открытой В. Гершелем (См. Гершель) в 1781. В металлическом состоянии У. получен в 1841 франц. химиком Э. Пелиго при восстановлении UCl4 металлическим калием. Первоначально У. приписывали атомную массу 120, и только в 1871 Д. И. Менделеев пришёл к выводу, что эту величину надо удвоить.
Длительное время уран представлял интерес только для узкого круга химиков и находил ограниченное применение для производства красок и стекла. С открытием явления радиоактивности (См. Радиоактивность) У. в 1896 и радия (См. Радий) в 1898 началась промышленная переработка урановых руд с целью извлечения и использования радия в научных исследованиях и медицине. С 1942, после открытия в 1939 явления деления ядер (см. Ядра атомного деление), У. стал основным ядерным топливом.
Распространение в природе. У. - характерный элемент для гранитного слоя и осадочной оболочки земной коры. Среднее содержание У. в земной коре (кларк) 2,5·10-4\% по массе, в кислых изверженных породах 3,5·10-4\%, в глинах и сланцах 3,2·10-4\%, в основных породах 5·10-5\%, в ультраосновных породах мантии 3·10-7\%. У. энергично мигрирует в холодных и горячих, нейтральных и щелочных водах в форме простых и комплексных ионов, особенно в форме карбонатных комплексов. Важную роль в геохимии У. играют окислительно-восстановительные реакции, поскольку соединения У., как правило, хорошо растворимы в водах с окислительной средой и плохо растворимы в водах с восстановительной средой (например, сероводородных).
Известно около 100 минералов У.; промышленное значение имеют 12 из них (см. Урановые руды). В ходе геологической истории содержание У. в земной коре уменьшилось за счёт радиоактивного распада; с этим процессом связано накопление в земной коре атомов РЬ, Не. Радиоактивный распад У. играет важную роль в энергетике земной коры, являясь существенным источником глубинного тепла.
Физические свойства. У. по цвету похож на сталь, легко поддаётся обработке. Имеет три аллотропические модификации - α, β и γ с температурами фазовых превращений: α→β 668,8±0,4°C, β→ γ 772,2 ± 0,4 °С; α-форма имеет ромбическую решётку a = 2.8538Å, b = 5,8662Å, с = 4,9557Å), β-форма - тетрагональую решётку (при 720 °С а = 10,759Å, b = 5,656Å), γ-форма - объёмноцентрированную кубическую решётку (при 850°C а = 3,538Å). Плотность У. в α-форме (25°C) 19,05 ± 0,2 г/см3, tпл 1132 ± 1°С; tkип 3818 °С; теплопроводность (100-200°C), 28,05 вт/(м·К) [0,067 кал/(см·сек·°С)], (200-400 °C) 29,72 вт/(м·К) [0,071 кал/(см·сек·°С)]; удельная теплоёмкость (25°C) 27,67 кдж/(кг·К) [6,612 кал/(г·°С)]; удельное электросопротивление при комнатной температуре около 3·10-7 ом·см, при 600°C 5,5·10-7 ом·см; обладает сверхпроводимостью при 0,68 ± 0,02К; слабый парамагнетик, удельная магнитная восприимчивость при комнатной температуре 1,72·10-6.
Механические свойства У. зависят от его чистоты, от режимов механической и термической обработки. Среднее значение модуля упругости для литого У. 20,5·10-2 Мн/м2 [20,9·10-3 кгс/мм2] предел прочности при растяжении при комнатной температуре 372-470 Мн/м2 [38-48 кгс/мм2], прочность повышается после закалки из β- и γ-фаз; средняя твёрдость по Бринеллю 19,6-21,6·102 Мн/м2 [200-220 кгс/мм2].
Облучение потоком нейтронов (которое имеет место в ядерном реакторе (См. Ядерный реактор)) изменяет физико-механические свойства У.: развивается ползучесть и повышается хрупкость, наблюдается деформация изделий, что заставляет использовать У. в ядерных реакторах в виде различных урановых сплавов.
У. - радиоактивный элемент (См. Радиоактивные элементы). Ядра 235U и 233U делятся спонтанно, а также при захвате как медленных (тепловых), так и быстрых нейтронов с эффективным сечением деления 508·10-24 см2 (508 барн) и 533·10-24 см2 (533 барн) соответственно. Ядра 238U делятся при захвате только быстрых нейтронов с энергией не менее 1 Мэв; при захвате медленных нейтронов 238U превращается в 239Pu, ядерные свойства которого близки к 235U. Критич. масса У. (93,5\% 235U) в водных растворах составляет менее 1 кг, для открытого шара - около 50 кг, для шара с отражателем - 15 - 23 кг; критическая масса 233U - примерно 1/3 критической массы 235U.
Химические свойства. Конфигурация внешней электронной оболочки атома У. 7s26d15f3. У. относится к реакционноспособным металлам, в соединениях проявляет степени окисления + 3, + 4, + 5, + 6, иногда + 2; наиболее устойчивы соединения U (IV) и U (VI). На воздухе медленно окисляется с образованием на поверхности плёнки двуокиси, которая не предохраняет металл от дальнейшего окисления. В порошкообразном состоянии У. пирофорен и горит ярким пламенем. С кислородом образует двуокись UO2, трёхокись UO3 и большое число промежуточных окислов, важнейший из которых U3O8. Эти промежуточные окислы по свойствам близки к UO2 и UO3. При высоких температурах UO2 имеет широкую область гомогенности от UO1,60 до UO2,27. С фтором при 500-600°C образует тетрафторидирд (зелёные игольчатые кристаллы, малорастворимые в воде и кислотах) и гексафторид UF6 (белое кристаллическое вещество, возгоняющееся без плавления при 56,4°C); с серой - ряд соединений, из которых наибольшее значение имеет US (ядерное горючее). При взаимодействии У. с водородом при 220 °С получается гидрид UH3; с азотом при температуре от 450 до 700 °С и атмосферном давлении - нитрид U4N7, при более высоком давлении азота и той же температуре можно получить UN, U2N3 и UN2; с углеродом при 750-800°C - монокарбид UC, дикарбид UC2, а также U2C3; с металлами образует сплавы различных типов (см. Урановые сплавы). У. медленно реагирует с кипящей водой с образованием UO2 и H2, с водяным паром - в интервале температур 150-250 °С; растворяется в соляной и азотной кислотах, слабо - в концентрированной плавиковой кислоте. Для U (VI) характерно образование иона уранила UO22 +; соли уранила окрашены в жёлтый цвет и хорошо растворимы в воде и минеральных кислотах; соли U (IV) окрашены в зелёный цвет и менее растворимы; ион уранила чрезвычайно способен к комплексообразованию в водных растворах как с неорганическими, так и с органическими веществами; наиболее важны для технологии карбонатные, сульфатные, фторидные, фосфатные и др. комплексы. Известно большое число уранатов (солей не выделенной в чистом виде урановой кислоты), состав которых меняется в зависимости от условий получения; все уранаты имеют низкую растворимость в воде.
У. и его соединения радиационно и химически токсичны. Предельно допустимая доза (ПДД) при профессиональном облучении 5 бэр в год.
Получение. У. получают из урановых руд, содержащих 0,05-0,5\% U. Руды практически не обогащаются, за исключением ограниченного способа радиометрической сортировки, основанной на излучении радия, всегда сопутствующего урану. В основном руды выщелачивают растворами серной, иногда азотной кислот или растворами соды с переводом У. в кислый раствор в виде UO2SO4 или комплексных анионов [UO2(SO4)3]4-, а в содовый раствор - в виде [UO2(CO3)3]4-. Для извлечения и концентрирования У. из растворов и пульп, а также для очистки от примесей применяют сорбцию на ионообменных смолах и экстракцию органическими растворителями (трибутилфосфат, алкилфосфорные кислоты, амины). Далее из растворов добавлением щёлочи осаждают уранаты аммония или натрия или гидроокись U (OH)4. Для получения соединений высокой степени чистоты технические продукты растворяют в азотной кислоте и подвергают аффинажным операциям очистки, конечными продуктами которых являются UO3 или U3O8; эти окислы при 650-800°C восстанавливаются водородом или диссоциированным аммиаком до UO2 с последующим переводом его в UF4 обработкой газообразным фтористым водородом при 500-600°C. UF4 может быть получен также при осаждении кристаллогидрата UF4·nH2O плавиковой кислотой из растворов с последующим обезвоживанием продукта при 450°C в токе водорода. В промышленности основным способом получения У. из UF4 является его кальциетермическое или магниетермическое восстановление с выходом У. в виде слитков массой до 1,5 т. Слитки рафинируются в вакуумных печах.
Очень важным процессом в технологии У. является обогащение его изотопом 235U выше естественного содержания в рудах или выделение этого изотопа в чистом виде (см. Изотопов разделение), поскольку именно 235U - основное ядерное горючее; осуществляется это методами газовой термодиффузии, центробежными и др. методами, основанными на различии масс 235U и 238U; в процессах разделения У. используется в виде летучего гексафторида UF6. При получении У. высокой степени обогащения или изотопов учитываются их критические массы; наиболее удобный способ в этом случае - восстановление окислов У. кальцием; образующийся при этом шлак CaO легко отделяется от У. растворением в кислотах.
Для получения порошкообразного У., двуокиси, карбидов, нитридов и др. тугоплавких соединений применяются методы порошковой металлургии.
Применение. Металлический У. или его соединения используются в основном в качестве ядерного горючего в ядерных реакторах (См. Ядерный реактор). Природная или малообогащённая смесь изотопов У. применяется в стационарных реакторах атомных электростанций, продукт высокой степени обогащения - в ядерных силовых установках (См. Ядерная силовая установка) или в реакторах, работающих на быстрых нейтронах. 235U является источником ядерной энергии в ядерном оружии (См. Ядерное оружие). 238U служит источником вторичного ядерного горючего - плутония.
В. М. Кулифеев.
Уран в организме. В микроколичествах (10-5-10-5\%) обнаруживается в тканях растений, животных и человека. В золе растений (при содержании У. в почве около·10-4) его концентрация составляет 1,5·10-5\%. В наибольшей степени У. накапливается некоторыми грибами и водорослями (последние активно участвуют в биогенной миграции У. по цепи вода - водные растения - рыба - человек). В организм животных и человека У. поступает с пищей и водой в желудочно-кишечный тракт, с воздухом в дыхательные пути, а также через кожные покровы и слизистые оболочки. Соединения У. всасываются в желудочно-кишечном тракте - около 1\% от поступающего количества растворимых соединений и не более 0,1\% труднорастворимых; в лёгких всасываются соответственно 50\% и 20\%. Распределяется У. в организме неравномерно. Основные депо (места отложения и накопления) - селезёнка, почки, скелет, печень и, при вдыхании труднорастворимых соединений, - лёгкие и бронхо-лёгочные лимфатические узлы. В крови У. (в виде карбонатов и комплексов с белками) длительно не циркулирует. Содержание У. в органах и тканях животных и человека не превышает 10-7 г/г. Так, кровь крупного рогатого скота содержит 1·10-8 г/мл, печень 8·10-8 г/г, мышцы 4·10-8 г/г, селезёнка 9·10-8 г/г. Содержание У. в органах человека составляет: в печени 6·10-9 г/г, в лёгких 6·10-9-9·10-9г/г, в селезёнке 4,7·10-9 г/г, в крови 4·10-9 г/мл, в почках 5,3·10-9 (корковый слой) и 1,3·10-9 г/г (мозговой слой), в костях 1·10-9 г/г, в костном мозге 1·10-9 г/г, в волосах 1,3·10-7г/г. У., содержащийся в костной ткани, обусловливает её постоянное облучение (период полувыведения У. из скелета около 300 сут). Наименьшие концентрации У. - в головном мозге и сердце (10-10 г/г). Суточное поступление У. с пищей и жидкостями - 1,9·10-6 г, с воздухом - 7·10-9 г. Суточное выведение У. из организма человека составляет: с мочой 0,5·10-7-5·10-7, с калом - 1,4·10-6-1,8·10-6 г, с волосами - 2·10-8г.
По данным Международной комиссии по радиационной защите, среднее содержание У. в организме человека 9·10-8 г. Эта величина для различных районов может варьировать. Полагают, что У. необходим для нормальной жизнедеятельности животных и растений, однако его физиологические функции не выяснены.
Г. П. Галибин.
Токсическое действие У. обусловлено его химическими свойствами и зависит от растворимости: более токсичны уранил и др. растворимые соединения У. Отравления У. и его соединениями возможны на предприятиях по добыче и переработке уранового сырья и др. промышленных объектах, где он используется в технологическом процессе. При попадании в организм У. действует на все органы и ткани, являясь общеклеточным ядом. Признаки отравления обусловлены преим. поражением почек (появление белка и сахара в моче, последующая Олигурия), поражаются также печень и желудочно-кишечный тракт. Различают острые и хронические отравления; последние характеризуются постепенным развитием и меньшей выраженностью симптомов. При хронической интоксикации возможны нарушения кроветворения, нервной системы и др. Полагают, что молекулярный механизм действия У. связан с его способностью подавлять активность ферментов.
Профилактика отравлений: непрерывность технологических процессов, использование герметичной аппаратуры, предупреждение загрязнения воздушной среды, очистка сточных вод перед спуском их в водоёмы, мед. контроль за состоянием здоровья рабочих, за соблюдением гигиенических нормативов допустимого содержания У. и его соединений в окружающей среде.
В. Ф. Кириллов.
Лит.: Учение о радиоактивности. История и современность, под ред. Б. М. Кедрова, М., 1973; Петросьянц А. М., От научного поиска к атомной промышленности, М., 1970; Емельянов В. С., Евстюхин А. И., Металлургия ядерного горючего, М., 1964; Сокурский Ю. Н., Стерлин Я. М., Федорченко В. А., Уран и его сплавы, М., 1971; Евсеева Л. С., Перельман А. И., Иванов К. Е., Геохимия урана в зоне гнпергениза, 2 изд., М., 1974; Фармакология и токсикология урановых соединений, [пер. с англ.], т. 2, М., 1951; Гуськова В. Н., Уран. Радиационно-гигиеническая характеристика, М., 1972; Андреева О. С., Гигиена труда при работе с ураном и его соединениями, М., 1960; Новиков Ю. В,, Гигиенические вопросы изучения содержания урана во внешней среде и его влияния на организм, М., 1974.
уран
м.
Радиоактивный химический элемент.
Радиоактивный химический элемент.
УРАН
химический элемент, серебристо-белый металл, обладающий радиоактивными свойствами.
УРАН
а, м.
1. одуш., с прописной буквы. В древнегреческой мифологии: бог неба.
2. астр., с прописной буквы. Седьмая по расстоянию от Солнца планета Солнечной системы.||Ср. ВЕНЕРА, МАРС I, МЕРКУРИЙ, НЕПТУН, ПЛУТОН, САТУРН, ЮПИТЕР I.
3. мн. нет. Радиоактивный химический элемент, серебристо-белый металл. Урановый - относящийся к урану.
УРАН
в греческой мифологии бог неба, супруг Геи (Земли), отец титанов, киклопов и сторуких исполинов; был свергнут сыном - богом Кроносом.
---
(астрономический знак X) , планета, среднее расстояние от Солнца - 19,18 а. е. (2871 млн. км), период обращения 84 года, период вращения ок. 17 ч, экваториальный диаметр 51 200 км, масса 8,7·1025 кг, состав атмосферы: Н2, Не, СН4. Ось вращения Урана наклонена на угол 98 °. Уран имеет 15 спутников (5 открыты с Земли - Миранда, Ариэль, Умбриэль, Титания, Оберон, и 10 открыты космическим аппаратом "Вояджер-2" - Корделия, Офелия, Бианка, Крессида, Дездемона, Джульетта, Порция, Розалинда, Белинда, Пэк) и систему колец.
---
(лат. Uranium), U, химический элемент III группы периодической системы Менделеева, атомный номер 92, атомная масса 238,0289, относится к актиноидам. Радиоактивен, наиболее устойчивый изотоп 238U (период полураспада 4,47·109 лет). Название от планеты Уран. Серебристо-белый металл, плотность 19,04 г/см3, tпл 1134 °С. Химически активен (порошкообразный уран при нагревании загорается). Минералы - уранинит, настуран, урановые черни, карнотит, тюямунит. Природный уран состоит из смеси 3 изотопов: 238U (99,282%), 235U (0,712%) и 234U (0,006%). Уран - ядерное топливо; из него получают изотоп плутония 239Pu. 235U - вторичное ядерное горючее.
---
(астрономический знак X) , планета, среднее расстояние от Солнца - 19,18 а. е. (2871 млн. км), период обращения 84 года, период вращения ок. 17 ч, экваториальный диаметр 51 200 км, масса 8,7·1025 кг, состав атмосферы: Н2, Не, СН4. Ось вращения Урана наклонена на угол 98 °. Уран имеет 15 спутников (5 открыты с Земли - Миранда, Ариэль, Умбриэль, Титания, Оберон, и 10 открыты космическим аппаратом "Вояджер-2" - Корделия, Офелия, Бианка, Крессида, Дездемона, Джульетта, Порция, Розалинда, Белинда, Пэк) и систему колец.
---
(лат. Uranium), U, химический элемент III группы периодической системы Менделеева, атомный номер 92, атомная масса 238,0289, относится к актиноидам. Радиоактивен, наиболее устойчивый изотоп 238U (период полураспада 4,47·109 лет). Название от планеты Уран. Серебристо-белый металл, плотность 19,04 г/см3, tпл 1134 °С. Химически активен (порошкообразный уран при нагревании загорается). Минералы - уранинит, настуран, урановые черни, карнотит, тюямунит. Природный уран состоит из смеси 3 изотопов: 238U (99,282%), 235U (0,712%) и 234U (0,006%). Уран - ядерное топливо; из него получают изотоп плутония 239Pu. 235U - вторичное ядерное горючее.
Википедия
Уран
Уран (др.-греч. Οὐρανός — небо) — в греческой мифологии бог, олицетворяющий небо, относится к самому древнему поколению богов.
- Уран — планета Солнечной системы, названа в честь греческого бога неба Урана.
- Уран (лат. Uranium) — химический элемент с атомным номером 92, относится к семейству актиноидов.

