связывает давление
р, объём
V и температуру Т физически однородной системы в состоянии равновесия термодинамического (См.
Равновесие термодинамическое)
: f (
p, V, Т)
= 0. Это
уравнение называется термическим У. с., в отличие от калорического У. с., определяющего внутреннюю энергию (См.
Внутренняя энергия) системы
U как функцию какого-либо двух из трёх параметров
р, V, Т. Термическое У. с. позволяет выразить давление через объём и температуру
р = p (
V, Т) и определить элементарную работу δ
A = =
pδ
V при бесконечно малом расширении системы δ
V. У. с. является необходимым дополнением к термодинамическим законам, которое делает возможным их применение к реальным веществам. Оно не может быть выведено с помощью одних только законов термодинамики (См.
Термодинамика)
, а определяется или рассчитывается теоретически на основе представлений о строении вещества методами статистической физики (См.
Статистическая физика)
. Из первого начала термодинамики (См.
Первое начало термодинамики) следует лишь существование калорического У. с., а из второго начала термодинамики (См.
Второе начало термодинамики) - связь между термическим и калорическим У. с.
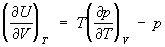 ,
, откуда вытекает, что для идеального газа (См.
Идеальный газ)внутренняя энергия не зависит от объёма
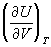
= 0. Термодинамика показывает, что для вычисления как термического, так и калорического У. с., достаточно знать любой из потенциалов термодинамических (См.
Потенциалы термодинамические)
в виде функции своих параметров. Например, если известна
Гельмгольцева энергия F как функция
Т и
V, то У. с. находят дифференцированием:
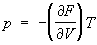
,
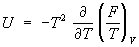
.
Ван-дер-Ваальса уравнение 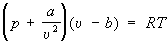 ,
, где
а и
b - постоянные, зависящие от природы газа и учитывающие влияние сил притяжения между молекулами и конечность из объёма, вириальное У. с. для неидеального pυ / RT = 1 + B (
T)
/ υ
+ С (
Т)/ υ
2 +.., где
В (
Т)
, С (
Т)
... - 2-й, 3-й и т.д. вириальные коэффициенты, зависящие от сил взаимодействия между молекулами (см.
Газы)
. Это
уравнение является наиболее надёжным и теоретически обоснованным У. с. для газов и позволяет объяснить многочисленные экспериментальные результаты на основании простых моделей межмолекулярного взаимодействия (См.
Межмолекулярное взаимодействие)
. Были предложены также различные эмпирические У. с., основанные на экспериментальных данных о теплоёмкости и сжимаемости. У. с. неидеальных газов указывает на существование критической точки (с параметрами
pk, Vk, Tk)
, в которой газообразная и жидкая фазы становятся идентичными (см.
Критическое состояние)
. Если У. с. представить в виде приведенного У. с., т. е. в безразмерных переменных
p/pk, V/Vk, T/Tk, то при не слишком низких температурах это
уравнение мало меняется для различных веществ (закон соответственных состояний (См.
Соответственные состояния))
.
Для равновесного излучения, или фотонного газа, У. с. определяется Планка законом излучения (См.
Планка закон излучения) для средней плотности энергии.
Для жидкостей из-за сложности учёта всех особенностей взаимодействия молекул пока не удалось теоретически получить общее У. с.
Уравнение Ван-дер-Ваальса хотя и применяют для качественной оценки поведения жидкостей, но оно по существу неприменимо ниже критической точки, когда возможно сосуществование жидкой и газообразной фаз. У. с., хорошо описывающее свойства ряда простых жидкостей, можно получить из приближённых теорий жидкого
состояния типа теории свободного объёма или дырочной теории (см.
Жидкость)
. Знание распределения вероятности взаимного расположения молекул (парной корреляционной функции) принципиально позволяет вычислить У. с. жидкости, но эта задача очень сложна и полностью ещё не решена даже с помощью вычислительных машин.
Для твёрдых тел термическое У. с. определяет зависимость модулей упругости (См.
Модули упругости) от температуры и давления. Оно может быть получено на основании теории теплового движения в кристаллах, рассматривающей
Фононы и их взаимодействие, но пока общего У. с. для твёрдых тел не найдено.
Для магнитных сред элементарная работа при намагничивании равна δA = -НδМ, где М - магнитный момент, Н - напряжённость магнитного поля. Следовательно, зависимость М = М (Н, Т) представляет собой магнитное У. с.
Для электрически поляризуемых сред элементарная работа при поляризации равна δA = -ЕδР где Р - поляризация, Е - напряжённость электрического поля, следовательно, У. с. имеет вид Р = (Е, Т).
Лит.: Хилл Т., Статистическая механика, пер. с англ., М., 1960; Вукалович М. П., Новиков И. И., Уравн
ение состо
яния реальных газов, М. - Л., 1948; Мейсон Э., Сперлинг Т., Вириальное
уравнение состояния, пер. с англ., М., 1972; Лейбфрид Г., Людвиг В., Теория ангармонических эффектов в кристаллах, пер. с англ., М., 1963. См. также лит. при статьях
Статистическая физика и
Термодинамика.
Д. Н. Зубарев.

