биокатализ, ускорение химических реакций под влиянием ферментов (См.
Ферменты)
. В основе жизнедеятельности лежат многочисленные химические реакции расщепления питательных веществ, синтеза необходимых организму химических соединений и трансформации их энергии в энергию физиологических процессов (работа мышц, почек, нервная деятельность и т.п.). Все эти реакции не могли бы происходить с необходимой для живых организмов скоростью, если бы в ходе эволюции не возникли механизмы их ускорения с помощью Ф. к.
Одно время считалось, что Ф. к. принципиально отличается от небиологического
Катализа
, широко используемого в химическом производстве. Такое представление основывалось на трёх отличительных особенностях Ф. к.: исключительно высокой эффективности (увеличение скорости реакции в 10
10-10
13 раз) и специфичности, т. е. избирательности (способности каждого фермента катализировать превращение строго определённых биологических субстратов, иногда лишь единственного вещества, в единственном направлении), не достижимых в небиологическом катализе. Особенностью Ф. к. является также его регулируемость - способность биокатализатора - фермента - увеличивать или уменьшать свою активность в зависимости от потребностей организма. Однако исследование механизма Ф. к. показывает, что к нему применимы законы и принципы, на которых основаны обычные химические реакции. Отличие реакций Ф. к. определяется сложностью структуры ферментов и химических превращений, которые совершают вещества в ходе катализа.
Эффективность Ф. к. достигается в результате того, что химическая реакция разбивается на ряд энергетически более лёгких промежуточных реакций, в которых участвует фермент. Важнейшая для Ф. к. реакция - образование первичного фермент-субстратного комплекса даёт выигрыш энергии, достаточный для ускорения процесса в целом. Представления о необходимости образования такого комплекса следовали из изучения зависимости скорости ферментативной реакции (V) от концентрации фермента (Е) и субстрата (S), которая описывается уравнением Михаэлиса - Ментен:
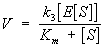
,
где k3 и Кт - константы, характерные для каждой реакции.
Эта зависимость, установленная экспериментально для многих ферментативных реакций, может быть теоретически выведена, если превращение субстрата в продукт реакции (Р) происходит по механизму образования и распада комплекса между ферментом и субстратом - ES-комплекса:
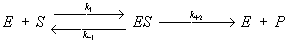
,
где k1, k-1 и k + 2 - константы, характеризующие скорость указанных стрелками стадий процесса, причём соотношение (k-1 + k + 2)/ k-1 = Кт. Если в реакции участвует не один, а несколько (в большинстве случаев два) субстратов и ES-комплекс образует продукты реакции не в одну, а в несколько стадий, зависимость выражается более сложными уравнениями, однако и они могут быть выведены лишь на основе представления о первичном образовании ES-комплексов. Для многих ферментов получены прямые доказательства образования ES-комплексов. Так, спектральными методами доказано образование комплексов с участием дегидрогеназ и пероксидаз; выделены в кристаллич. состоянии комплексы оксидазы D-аминокислот с D-aланином, карбоксипептидазы А с глицил-L-тирозином. В ряде случаев установлено пространственное строение ES-комплексов методом рентгеноструктурного анализа.
Высокая специфичность Ф. к. объясняется строгим геометрическим и электронным соответствием структуры субстрата структуре активного центра (См.
Активные центры) фермента, на котором субстрат сорбируется и далее претерпевает химические превращения. Допускается, что соответствие (комплементарность) геометрического и электронного строения активного центра и реагирующих с ним участков молекулы субстрата (субстратов) достигается в момент сближения субстрата с активным центром (гипотеза индуцированного соответствия Д. Э. Кошленда, США). Активный центр фермента, представляющий собой ансамбль химически активных группировок (функциональных групп аминокислот), формируется из остатков аминокислот, нередко расположенных далеко друг от друга в полипептидной цепи, но сближенных в пространстве в результате глобулярной структуры белка. Часто в построении активных центров участвуют низкомолекулярные вещества (ионы металлов, органические кофакторы). В молекуле α-химотрипсина, катализирующего гидролиз белков и полипептидов и имеющего цепь длиной в 246 аминокислотных остатков, активный центр образован остатками серина (порядковый номер остатка в цепи 195), гистидина (№ 57), изолейцина (№ 16) и аспарагиновой кислоты (№ 102 и № 194). Активный центр рибонуклеазы, катализирующей расщепление РНК и построенной из 124 аминокислот, образован остатками лизина (№ 7 и № 41), аргинина (№ 39) и гистидина (№ 12 и № 119). Активные центры мн. ферментов функционируют с участием низкомолекулярных веществ - кофакторов (См.
Кофакторы)
Ф. к. К ним относятся производные витаминов,
Коферменты, а также ионы некоторых металлов (Na, К, Ca, Mg, Zn, Fe, Сu, Со, Mo и др.).
Общая теория Ф. к. не разработана, однако результаты исследования механизма действия ферментов позволяют качественно, а в отдельных случаях и количественно объяснить высокую активность Ф. к. Её главные причины: 1) сближение реагентов при сорбции их в активном центре, этот фактор эквивалентен повышению концентрации реагирующих веществ; 2) специфическая ориентация сорбированного в активном центре субстрата, благоприятная для взаимодействия с каталитическим участком активного центра; 3) образование химических связей между субстратом и каталитическим участком активного центра, направляющее реакцию по энергетически наиболее лёгкому пути; 4) осуществление всех основных химических превращений субстрата "внутримолекулярно" - в составе фермент-субстратного комплекса; 5) исключительная гибкость молекулы фермента, позволяющая активному центру принимать на каждой стадии превращения фермент-субстратного комплекса строение, способствующее достижению максимальной скорости данной стадии реакции. Каждая предшествующая стадия подготавливает наилучшие условия для последующей. Ориентировочная оценка суммарного эффекта всех перечисленных факторов Ф. к. позволяет теоретически предсказать возможное ускорение реакции в 1010-1013 раз, что во многих случаях совпадает с найденной экспериментально величиной.
Механизмы регуляции активности Ф. к. связаны с особенностями белковой структуры ферментов. Глобулярное строение ферментов, поддерживаемое относительно слабыми химическими связями между отдельными участками полипептидной цепи, легко нарушается при изменении кислотности среды, температуры, концентрации солей в клетках и т.п. Поскольку для Ф. к. необходима строго заданная структура фермента, все эти факторы оказывают воздействие на его активность. Каждый фермент максимально активен при определённой температуре, pH среды и т.п. Изменение условий среды в обе стороны от оптимума снижает активность Ф. к.; нередко она саморегулируется продуктом реакции. Для обратимых процессов, когда фермент катализирует прямую и обратную реакции, скорость прямой реакции (активность Ф. к.) уменьшается при образовании избытка продукта реакции.
Важную роль в Ф. к. играет т. н. аллостерическая регуляция активности ферментов. В живой клетке совершается множество последовательных химических реакций, катализируемых соответствующими ферментами E1, E2 и т.п.
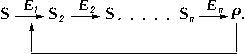
Обнаружены многочисленные реакции, когда образующийся в избытке против физиологически необходимых количеств продукт
Р способен снижать активность первого фермента
E1 и тем самым уменьшать скорость всей цепи реакций. Такой механизм называется регуляцией по принципу обратной связи. При этом регулятор Р (в общем случае носит наименование эффектор) воздействует на специальный регуляторный центр фермента
E1, расположенный вдали от активного центра. Однако вследствие подвижности структуры белковой молекулы фермента в целом реакция с регуляторным центром приводит к изменению строения и свойств активного центра. Такой участок получил, по предложению Ф.
Жакоба и Ж.
Моно, наименование аллостерического центра, а сами ферменты типа
E1 называется аллостерическими ферментами. В качестве аллостерических эффекторов часто выступают нуклеотиды (например, адениловая кислота, аденозинтрифосфат и т.п.) и аминокислоты (в реакциях биосинтеза др. аминокислот).
К аллостерическим относят также механизмы регуляции действия фермента, содержащего несколько активных центров, при которых связывание субстрата в активном центре вызывает изменение (уменьшение или увеличение) активности фермента. Аллостерическими свойствами обладают ферменты, построенные из нескольких (чётного числа) молекул, каждая из которых имеет активный и регуляторный центры. Воздействие эффектора на регуляторный центр одной из молекул вызывает общее (кооперативное) изменение строения в др. молекулах и активности фермента в целом. Возможны также регуляторные механизмы, при которых воздействие эффектора на аллостерический фермент приводит к изменению степени ассоциации составляющих его субъединиц, что также сопровождается изменением общей активности фермента. Такого рода механизмы играют важную роль в регуляции сложной системы химических реакций (обмена веществ (См.
Обмен веществ)) в живом организме.
Лит.: "Журнал Всес. химического общества им. Д. И. Менделеева", 1971, т. 16, № 4; Дженке В, П., Катализ в химии и энзимологии, пер. с англ., М., 1972: Структура и функции активных центров ферментов. Сб., посвященный 70-летию со дня рождения А. Е. Браунштейна, М., 1974.
В. А. Яковлев.
