Введите слово или словосочетание на любом языке 👆
Язык:
Перевод и анализ слов искусственным интеллектом ChatGPT
На этой странице Вы можете получить подробный анализ слова или словосочетания, произведенный с помощью лучшей на сегодняшний день технологии искусственного интеллекта:
- как употребляется слово
- частота употребления
- используется оно чаще в устной или письменной речи
- варианты перевода слова
- примеры употребления (несколько фраз с переводом)
- этимология
Что (кто) такое единица белкового азота - определение
ХИМИЧЕСКОЕ СОЕДИНЕНИЕ
Оксид азота (II); NO; Окись азота; Моноксид азота; Монооксид азота; Нитрозил
Фториды азота
СТРАНИЦА ЗНАЧЕНИЙ В ПРОЕКТЕ ВИКИМЕДИА
Азота фториды
неорганические соединения, содержащие связь N-F, например трифторид азота NF3, тетрафторгидразин N2F4, дифторамин NF2H, фтористый нитрозил FNO и др. Ф. а. - бесцветные газы со специфическим запахом. При нагревании разлагаются на элементы или трифторид азота и азот (за исключением NF3 и FNO). Проявляют свойства сильных окислителей. С органическими соединениями некоторые Ф. а. образуют многочисленные органические вещества, содержащие группы -NF2 и -NONF. Особенность Ф. а. состоит в том, что при взаимодействии с сильными льюисовскими кислотами (см. Кислоты и основания) они образуют соли с фторазотными катионами 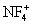 ,
, 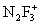 ,
, 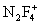 , F2NO+.
, F2NO+.
Трифторид азота, NF3 - газ; tпл - 208,5°С, tkип - 129,1°С. Окислительная способность проявляется при высоких температурах. Превращается в тетрафторгидразин при повышенных температурах и в присутствии меди, железа, ртути или угля. Получается электролизом расплава дифторида аммония или фторированием азотсодержащих веществ. Применяется в производстве тетрафторгидразина.
Тетрафторгидразин, N2F4 - газ; tпл - 161,5°С, tkип - 74,2°С. Способен к диссоциации: N2F4 ⇔ 2NF2. При 150°С и давлении 0,1 Мн/м2 (1 кгс/см2) степень диссоциации 0,2. Диссоциация N2F4 обусловливает его дифтораминирующее действие, которое проявляется, например, в присоединении к олефинам:
. Тетрафторгидразин получается конверсией трифторида азота над углём (промышленный метод), разложением NF2H или окислением его растворов. Применяется для синтеза органических дифтораминосоединений.
Дифторамин, NF2H - газ; tпл - 116°С, tkип - 23°С. Взрывается при ударе (особенно в жидком и твёрдом состояниях). Проявляет амфотерные свойства. В реакциях действует как дифтораминирующий агент. Получается действием серной кислоты на дифтораминомочевину (продукт фторирования мочевины) или на трифенилметил дифторамин, синтезируемый из N2F4 и трифенилметилхлорида в присутствии ртути. Применяется для синтеза органических дифтораминосоединений.
Лит.: Панкратов А. В., Химия фторидов азота, М., 1973.
А. В. Панкратов.
Фториды азота
СТРАНИЦА ЗНАЧЕНИЙ В ПРОЕКТЕ ВИКИМЕДИА
Азота фториды
Фториды азота — неорганические соединения азота со фтором. Известны трифторид азота NF, Дифтордиазин NF, тетрафторгидразин NF, азид фтора FN, а также оксифторид азота NOF.
Системы закиси азота
Система закиси азота; Нитрос; Нитроускоритель
Система окиси азота (NOS — от ) — система, использующаяся для изменения технических характеристик двигателей внутреннего сгорания. Вещество, содержащее закись азота, и горючее впрыскиваются во впускной коллектор двигателя.
Википедия
Оксид азота(II)

Окси́д азо́та(II) (мон(о)оксид азота, окись азота, нитрозил-радикал) NO — несолеобразующий оксид азота. Молекула года (1992)
Наличие неспаренного электрона обусловливает склонность NO к образованию слабосвязанных димеров N2O2. Это непрочные соединения с ΔH° димеризации около 17 кДж/моль. Жидкий оксид азота(II) на 25 % состоит из молекул N2O2, а твёрдый целиком состоит из них.

![ядрышки]] (светло-зелёные) ядрышки]] (светло-зелёные)](https://commons.wikimedia.org/wiki/Special:FilePath/The production and diffusion of nitric oxide (NO) (white) in the cytoplasm (green) of clusters of conifer cells one hour after mechanical agitation.jpg?width=200)

